Hosszan veszel egy nagyon forró zuhanyt, a fürdőszobai tükröt pára borítja. Az ablakon felejtesz egy fazék vizet, aztán rájössz, hogy a víz felforrt, és a serpenyő leégett. Azt gondolhatnánk, hogy a víz szeret gázból folyadékká, majd folyékonyból gázzá válni. De mikor történik ez?
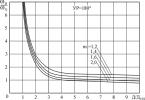
Szellőztetett térben a víz fokozatosan elpárolog bármilyen hőmérsékleten. De csak bizonyos feltételek mellett forr fel. A forráspont a folyadék feletti nyomástól függ. Normál légköri nyomáson a forráspont 100 fok lesz. A magassággal csökken a nyomás és a forráspont is. A Mont Blanc tetején 85 fok lesz, és ott nem lehet finom teát főzni! De egy gyorsfőzőben, amikor megszólal a síp, a víz hőmérséklete már 130 fok, és a nyomás négyszer magasabb, mint a légköri nyomás. Ezen a hőmérsékleten az étel gyorsabban megsül, és az ízek sem szöknek ki a sráccal, mert a szelep zárva van.
Egy anyag aggregációs állapotának változása a hőmérséklet változásával.
Bármely folyadék gáz halmazállapotúvá alakulhat, ha kellően melegítjük, és bármilyen gáz folyékony halmazállapotúvá alakulhat, ha lehűtjük. Ezért a gáztűzhelyekben és az országban használt butánt zárt palackokban tárolják. Folyékony és nyomás alatt van, mint egy gyorsfőző. A szabad levegőn pedig 0 fok alatti hőmérsékleten a metán nagyon gyorsan felforr és elpárolog. A cseppfolyósított metánt óriási tartályokban, úgynevezett tartályokban tárolják. Normál légköri nyomáson a metán 160 fokos nulla alatti hőmérsékleten forr. Annak érdekében, hogy a gáz ne szökjön ki szállítás közben, a tartályokat óvatosan érintik, mint a termoszokat.
Egy anyag aggregált állapotának változása nyomásváltozással.
Egy anyag folyékony és gáz halmazállapota között függ a hőmérséklet és a nyomás. Mivel egy anyag folyékony halmazállapotban telítettebb, mint gáz halmazállapotban, azt gondolhatja, hogy ha növeli a nyomást, a gáz azonnal folyadékká válik. De ez nem igaz. Ha azonban kerékpárszivattyúval kezdi a levegőt összenyomni, azt tapasztalja, hogy az felmelegszik. Felhalmozza azt az energiát, amelyet a dugattyú megnyomásával átad neki. A gáz csak akkor sűríthető folyadékká, ha egyidejűleg hűtjük. Éppen ellenkezőleg, a folyadékoknak hőt kell kapniuk ahhoz, hogy gázzá alakuljanak. Éppen ezért az alkohol vagy az éter elpárologtatása hőt von el a testünkből, hideg érzetet keltve a bőrön. A tengervíz elpárolgása a szél hatására hűti a vízfelszínt, az izzadás pedig a testet.
A keverékek nem csak abban különbözhetnek egymástól fogalmazás, hanem általa is kinézet. Aszerint, hogy ez a keverék hogyan néz ki és milyen tulajdonságai vannak, bármelyik kategóriába sorolható homogén (homogén), vagy arra heterogén (heterogén) keverékek.
Homogén (homogén) Ezek olyan keverékek, amelyekben más anyagok részecskéi még mikroszkóppal sem mutathatók ki.
Az ilyen keverék minden részének összetétele és fizikai tulajdonságai azonosak, mivel az egyes komponensek között nincsenek határfelületek.
NAK NEK homogén keverékek viszonyul:
- gázkeverékek;
- megoldások;
- ötvözetek.
Gázkeverékek
Ilyen homogén keverékre példa az levegő.
A tiszta levegő különféle anyagokat tartalmaz gáznemű anyagok:
- nitrogén (térfogathányada tiszta levegőben \(78\)%));
- oxigén (\(21\)%));
- nemesgázok - argon és mások (\(0,96\)%));
- szén-dioxid (\(0,04\)%).
A gáznemű keverék az földgázÉs kapcsolódó kőolajgáz. Ezeknek a keverékeknek a fő összetevői a gáznemű szénhidrogének: metán, etán, propán és bután.
Szintén gáznemű keverék egy megújuló erőforrás, mint pl biogáz, akkor keletkezik, amikor a baktériumok a szerves maradványokat hulladéklerakókban, szennyvíztisztító tartályokban és speciális berendezésekben dolgozzák fel. A biogáz fő összetevője az metán, amely szén-dioxid, hidrogén-szulfid és számos egyéb gáz halmazállapotú anyag keverékét tartalmazza.
Gázkeverékek: levegő és biogáz. A levegőt el lehet adni a kíváncsi turistáknak, és a zöld tömegből speciális konténerekben nyert biogáz üzemanyagként használható
Megoldások
Általában így nevezik a folyékony anyagkeverékeket, bár a tudományban ennek a kifejezésnek tágabb jelentése van: az oldatot általában ún. Bármi(beleértve a gáz- és szilárd halmazállapotúakat is) homogén keverék anyagokat. Tehát a folyékony oldatokról.
A természetben található fontos megoldás az olaj. A feldolgozás során nyert folyékony termékek: benzin, kerozin, gázolaj, fűtőolaj, kenőolajok- szintén különböző keverékek szénhidrogének.
Figyelj!
Az oldat elkészítéséhez össze kell keverni egy gáznemű, folyékony vagy szilárd anyagot oldószerrel (vízzel, alkohollal, acetonnal stb.).
Például, ammónia ammóniagáz feloldásával nyerjük a bemenetben. Viszont főzéshez jód tinktúrák A kristályos jódot etil-alkoholban (etanolban) oldják.
Folyékony homogén keverékek (oldatok): olaj és ammónia
Az ötvözet (szilárd oldat) alapján nyerhető bármilyen fém, és összetétele sok különböző anyagot tartalmazhat.
Jelenleg a legfontosabbak vasötvözetek- öntöttvas és acél.
Az öntöttvasok több mint \(2\)% szenet tartalmazó vasötvözetek, az acélok pedig kevesebb szenet tartalmazó vasötvözetek.
Amit általában "vasnak" neveznek, az valójában alacsony széntartalmú acél. Kivéve szén vasötvözetek tartalmazhatnak szilícium, foszfor, kén.
egyfázisú rendszerek, amelyek két vagy több komponensből állnak. Az oldatok aggregáltsági állapotuk szerint lehetnek szilárdak, folyékonyak vagy gázneműek. Tehát a levegő gázhalmazállapotú oldat, gázok homogén keveréke; vodka- folyékony oldat, több anyag egy folyékony fázist alkotó keveréke; tengervíz- folyékony oldat, szilárd (só) és folyékony (víz) anyagok keveréke, amely egy folyékony fázist alkot; sárgaréz- szilárd oldat, két szilárd anyag (réz és cink) keveréke, amely egy szilárd fázist alkot. A benzin és a víz keveréke nem megoldás, mert ezek a folyadékok nem oldódnak egymásban, két folyadékfázisként maradnak meg határfelülettel. Az oldatok komponensei megőrzik egyedi tulajdonságaikat, és nem lépnek kémiai reakcióba egymással új vegyületek képződéséhez. Így, ha két térfogat hidrogént egy térfogat oxigénnel keverünk össze, gáz halmazállapotú oldatot kapunk. Ha ezt a gázelegyet meggyújtják, új anyag képződik- víz, ami önmagában nem megoldás. Az oldatban nagyobb mennyiségben jelenlévő komponenst általában oldószernek nevezik, a többi komponenst- oldott anyagok.Néha azonban nehéz meghúzni a határvonalat az anyagok fizikai keveredése és kémiai kölcsönhatása között. Például hidrogén-klorid gáz HCl vízzel való keverésekor
H2O H ionok keletkeznek 3 O+ és Cl - . Magukhoz vonzzák a szomszédos vízmolekulákat, így hidrátokat képeznek. Így a kiindulási komponensek a HCl és a H 2 O - keverés után jelentős változásokon mennek keresztül. Ennek ellenére az ionizációt és a hidratálást (általános esetben a szolvatációt) olyan fizikai folyamatnak tekintjük, amely az oldatok képződése során megy végbe.A homogén fázist képviselő keverékek egyik legfontosabb típusa a kolloid oldatok: gélek, szolok, emulziók és aeroszolok. A részecskeméret kolloid oldatban 1-1000 nm, valódi oldatban
~ 0,1 nm (a molekulaméret nagyságrendje szerint).Alapfogalmak. Két olyan anyagot, amelyek bármilyen arányban feloldódnak egymásban, és valódi oldatokat képeznek, kölcsönösen teljesen oldhatónak nevezzük. Az ilyen anyagok mindegyike gáz, sok folyadék (például etil-alkohol- víz, glicerin - víz, benzol - benzin), néhány szilárd anyag (például ezüst - arany). Szilárd oldatok előállításához először meg kell olvasztani a kiindulási anyagokat, majd össze kell keverni és hagyni kell megszilárdulni. Amikor teljesen kölcsönösen oldódnak, egy szilárd fázis képződik; ha az oldhatóság részleges, akkor az eredeti komponensek egyikének kis kristályai megmaradnak a kapott szilárd anyagban.Ha két komponens csak bizonyos arányban keverve alkot egy fázist, más esetekben pedig két fázis jelenik meg, akkor ezeket részben kölcsönösen oldhatónak nevezzük. Ilyen például a víz és a benzol: igazi oldatot csak úgy nyerünk belőlük, ha nagy mennyiségű benzolhoz kis mennyiségű vizet, vagy nagy térfogatú vízhez kis mennyiségű benzolt adunk. Ha egyenlő mennyiségű vizet és benzolt keverünk össze, kétfázisú folyadékrendszer jön létre. Alsó rétege víz, kis mennyiségű benzollal, a felső pedig
- benzolt kis mennyiségű vízzel. Vannak olyan anyagok is, amelyek egyáltalán nem oldódnak egymásban, például a víz és a higany. Ha két anyag csak részben oldódik egymásban, akkor adott hőmérsékleten és nyomáson van határa annak, hogy egyensúlyi körülmények között az egyik anyag mennyi oldatot tud alkotni a másikkal. A maximális oldott anyag koncentrációjú oldatot telítettnek nevezzük. Készíthetünk úgynevezett túltelített oldatot is, amelyben az oldott anyag koncentrációja még nagyobb, mint a telítetté. A túltelített oldatok azonban instabilak, és a körülmények legkisebb változásával, például keveréssel, porszemcsék bejutásával vagy oldott anyag kristályainak hozzáadásával a felesleges oldott anyag kicsapódik.Bármely folyadék azon a hőmérsékleten kezd forrni, amelyen a telített gőznyomása eléri a külső nyomást. Például a 101,3 kPa nyomású víz 100 °C-on forr
° C, mert ezen a hőmérsékleten a vízgőznyomás pontosan 101,3 kPa. Ha feloldunk valamilyen nem illékony anyagot vízben, annak gőznyomása csökken. Ahhoz, hogy a kapott oldat gőznyomása 101,3 kPa-ra csökkenjen, az oldatot 100 °C fölé kell melegíteni.° C. Ebből következik, hogy az oldat forráspontja mindig magasabb, mint a tiszta oldószer forráspontja. Hasonló módon magyarázzuk az oldatok fagyáspontjának csökkenését.Raoult törvénye. F. Raoult francia fizikus 1887-ben, különféle nem illékony folyadékok és szilárd anyagok oldatait tanulmányozva törvényt hozott létre, amely a nem elektrolitok híg oldatai feletti gőznyomás csökkenését a koncentrációval köti össze: a telített gőznyomás relatív csökkenését az oldat feletti oldószer megegyezik az oldott anyag móltörtével. A Raoult-törvény kimondja, hogy a híg oldat forráspontjának növekedése vagy fagyáspontjának csökkenése a tiszta oldószerhez képest arányos az oldott anyag moláris koncentrációjával (vagy móltörtével), és felhasználható a molekulatömeg meghatározására.Ideálisnak nevezzük azt a megoldást, amelynek viselkedése engedelmeskedik Raoult törvényének. A nem poláris gázok és folyadékok oldatai (amelyek molekulái elektromos térben nem változtatnak orientációt) állnak a legközelebb az ideálishoz. Ebben az esetben az oldódási hő nulla, és az oldatok tulajdonságai közvetlenül megjósolhatók az eredeti komponensek tulajdonságainak és keveredésük arányának ismeretében. Valós megoldások esetében ilyen előrejelzés nem adható. Amikor valódi oldatok keletkeznek, általában hő szabadul fel vagy nyel el. A hőleadó folyamatokat exotermnek, az abszorpciós folyamatokat endotermnek nevezzük.
Az oldat azon jellemzőit, amelyek elsősorban a koncentrációjától (az oldott anyag molekuláinak száma egységnyi térfogatra vagy tömegre vonatkoztatva), és nem az oldott anyag természetétől függnek, az ún.
kolligatív . Például a tiszta víz forráspontja normál légköri nyomáson 100° C, és 1 mól oldott (nem disszociáló) anyagot tartalmazó oldat forráspontja 1000 g vízben már 100,52° C, függetlenül az anyag természetétől. Ha az anyag disszociál, ionokat képezve, akkor a forráspont az oldott anyag összes részecskeszámának növekedésével arányosan növekszik, ami a disszociáció miatt meghaladja az oldathoz adott anyag molekuláinak számát. További fontos kolligatív mennyiségek az oldat fagyáspontja, az ozmotikus nyomás és az oldószergőz parciális nyomása.Oldatkoncentráció olyan mennyiség, amely az oldott anyag és az oldószer arányát tükrözi. Az olyan minőségi fogalmak, mint a „híg” és a „tömény”, csak azt jelzik, hogy az oldat kevés vagy sok oldott anyagot tartalmaz. Az oldatok koncentrációjának számszerűsítésére gyakran használnak százalékokat (tömeg vagy térfogat), a tudományos irodalomban pedig a mólszámot vagy a kémiai ekvivalenseket. (cm . ekvivalens tömeg)oldott anyag az oldószer vagy oldat egységnyi tömegére vagy térfogatára vonatkoztatva. A félreértések elkerülése érdekében a koncentráció mértékegységeit mindig pontosan kell megadni. Tekintsük a következő példát. 90 g vízből (térfogata 90 ml, mivel a víz sűrűsége 1 g/ml) és 10 g etil-alkoholból (térfogata 12,6 ml, mivel az alkohol sűrűsége 0,794 g/ml) áll. tömege 100 g, de ennek az oldatnak a térfogata 101,6 ml (és ez 102,6 ml-nek felelne meg, ha a víz és az alkohol összekeverésekor térfogatukat egyszerűen összeadnánk). Az oldat százalékos koncentrációja többféleképpen számítható ki: vagy

A leggyakoribb mértékegység a molaritás, de van néhány félreértés, amelyet figyelembe kell venni a kiszámításakor. Például egy adott anyag 1 mólos oldatának előállításához egy mol-nak megfelelő, pontosan kimért részt feloldunk ismert kis mennyiségű vízben. tömegét grammban megadjuk, és az oldat térfogatát 1 literre emeljük. Az oldat elkészítéséhez szükséges víz mennyisége a hőmérséklettől és a nyomástól függően kissé változhat. Ezért két különböző körülmények között készített egymólos oldat koncentrációja valójában nem teljesen azonos. A molalitást egy bizonyos oldószertömeg (1000 g) alapján számítják ki, amely nem függ a hőmérséklettől és a nyomástól. A laboratóriumi gyakorlatban sokkal kényelmesebb bizonyos folyadékmennyiségek mérése (ehhez vannak büretták, pipetták és mérőlombikok), mint lemérni, ezért a tudományos irodalomban a koncentrációkat gyakran mólokban fejezik ki, a molalitás pedig általában csak különösen pontos mérésekhez használják.
A normalitást a számítások egyszerűsítésére használják. Mint már említettük, az anyagok az egyenértéküknek megfelelő mennyiségben lépnek kölcsönhatásba egymással. Különböző, azonos normalitású anyagok oldatait készítve és azonos térfogatokat véve biztosak lehetünk abban, hogy azonos számú ekvivalenst tartalmaznak.
Azokban az esetekben, amikor nehéz (vagy szükségtelen) különbséget tenni az oldószer és az oldott anyag között, a koncentrációt móltörtekben mérik. A mólfrakciók, mint a molalitás, nem függnek a hőmérséklettől és a nyomástól.
Az oldott anyag és az oldat sűrűségének ismeretében az egyik koncentrációt át lehet alakítani a másikra: a molaritást molalitássá, móltörtté és fordítva. Egy adott oldott anyag és oldószer híg oldatainál ez a három mennyiség arányos egymással.
Oldhatóság egy adott anyag azon képessége, hogy más anyagokkal oldatot képez. Kvantitatívan egy gáz, folyadék vagy szilárd anyag oldhatóságát a telített oldatának adott hőmérsékleten való koncentrációjával mérjük. Ez az anyag fontos jellemzője, segít megérteni annak természetét, valamint befolyásolja azon reakciók lefolyását, amelyekben az anyag részt vesz.Gázok. Kémiai kölcsönhatás hiányában a gázok tetszőleges arányban keverednek egymással, és ebben az esetben nincs értelme telítésről beszélni. Amikor azonban egy gáz feloldódik egy folyadékban, a nyomástól és a hőmérséklettől függően van egy bizonyos határkoncentráció. A gázok oldhatósága egyes folyadékokban korrelál a cseppfolyósodási képességükkel. A legkönnyebben cseppfolyósítható gázok, mint például az NH 3, HCl, SO 2 , jobban oldódik, mint a nehezen cseppfolyósítható gázok, mint például az O 2, H 2 és ő. Ha kémiai kölcsönhatás lép fel az oldószer és a gáz között (például víz és NH között 3 vagy HCl) oldhatósága nő. Egy adott gáz oldhatósága az oldószer jellegétől függően változik, de a gázok növekvő oldhatóságának megfelelő elrendezése megközelítőleg azonos marad a különböző oldószereknél.Az oldódási folyamat engedelmeskedik Le Chatelier (1884) elvének: ha egy egyensúlyban lévő rendszer ki van téve bármilyen hatásnak, akkor a benne lezajló folyamatok hatására az egyensúly olyan irányba tolódik el, hogy a hatás csökken. A gázok folyadékokban való oldódása általában hőkibocsátással jár. Ugyanakkor a Le Chatelier-elvnek megfelelően a gázok oldhatósága csökken. Ez a csökkenés annál szembetűnőbb, minél nagyobb a gázok oldhatósága: az ilyen gázoknak is van
nagyobb az oldathő. A forralt vagy desztillált víz „puha” ízét a levegő hiánya magyarázza, mivel oldhatósága magas hőmérsékleten nagyon alacsony.A nyomás növekedésével a gázok oldhatósága nő. Henry törvénye (1803) szerint egy adott térfogatú folyadékban állandó hőmérsékleten oldódó gáz tömege arányos a nyomásával. Ezt a tulajdonságot szénsavas italok készítésére használják. A szén-dioxidot folyadékban 3-4 atm nyomáson oldják; ilyen körülmények között adott térfogatban 3-4-szer több gáz (tömeg) oldódhat fel, mint 1 atm. Amikor egy ilyen folyadékot tartalmazó tartályt kinyitnak, a nyomás leesik, és az oldott gáz egy része buborékok formájában szabadul fel. Hasonló hatás figyelhető meg egy üveg pezsgő kinyitásakor vagy a szén-dioxiddal telített talajvíz nagy mélységben történő elérésekor.
Ha gázkeveréket egy folyadékban oldunk, akkor mindegyik oldhatósága ugyanaz marad, mint más komponensek hiányában, ugyanolyan nyomáson, mint a keverék esetében (Dalton törvénye).
Folyadékok. Két folyadék kölcsönös oldhatóságát az határozza meg, hogy mennyire hasonló a molekuláik szerkezete („a hasonló a hasonlóban oldódik”). A nem poláris folyadékokat, például a szénhidrogéneket gyenge intermolekuláris kölcsönhatások jellemzik, így az egyik folyadék molekulái könnyen behatolnak egy másik folyadék molekulái közé, pl. a folyadékok jól összekeverednek. Ezzel szemben a poláris és a nem poláris folyadékok, például a víz és a szénhidrogének nem keverednek jól egymással. Minden vízmolekulának először ki kell menekülnie más hasonló molekulák környezetéből, amelyek erősen vonzzák magukhoz, és be kell hatolniuk az őt gyengén vonzó szénhidrogénmolekulák közé. Ezzel szemben a szénhidrogénmolekulák ahhoz, hogy vízben oldódjanak, a vízmolekulák közé kell préselődniük, leküzdve azok erős kölcsönös vonzását, ehhez pedig energiára van szükség. A hőmérséklet emelkedésével a molekulák kinetikus energiája nő, a molekulák közötti kölcsönhatások gyengülnek, a víz és a szénhidrogének oldhatósága nő. Jelentős hőmérséklet-emelkedéssel teljes kölcsönös oldhatóságuk érhető el. Ezt a hőmérsékletet felső kritikus oldat hőmérsékletnek (UCST) nevezik.Egyes esetekben két, részben elegyedő folyadék kölcsönös oldhatósága a hőmérséklet csökkenésével nő. Ez a hatás akkor lép fel, amikor a keverés során hő keletkezik, általában kémiai reakció eredményeként. A hőmérséklet jelentős csökkenésével, de nem fagyáspont alatt érhető el az alsó kritikus oldat hőmérséklet (LCST). Feltételezhető, hogy minden LCTE-vel rendelkező rendszer rendelkezik HCTE-vel is (a fordítva nem szükséges). A legtöbb esetben azonban az egyik keverőfolyadék a HTST alatti hőmérsékleten felforr. A nikotin-víz rendszer LCTR-je 61
° C, és a VCTR 208° C. 61-208 között° C, ezeknek a folyadékoknak korlátozott az oldhatósága, és ezen a tartományon kívül teljes kölcsönös oldhatóságuk van.Szilárd anyagok. Minden szilárd anyag korlátozottan oldódik folyadékokban. Telített oldataik adott hőmérsékleten bizonyos összetételűek, ami az oldott anyag és az oldószer természetétől függ. Így a nátrium-klorid oldhatósága vízben több milliószor nagyobb, mint a naftalin vízben való oldhatósága, és ha benzolban oldjuk, az ellenkező kép alakul ki. Ez a példa azt az általános szabályt szemlélteti, hogy a szilárd anyag könnyen feloldódik hasonló kémiai és fizikai tulajdonságokkal rendelkező folyadékban, de nem oldódik fel ellentétes tulajdonságú folyadékban.A sók általában könnyen oldódnak vízben, és kevésbé oldódnak más poláris oldószerekben, például alkoholban és folyékony ammóniában. Azonban a sók oldhatósága is jelentősen változik: például az ammónium-nitrát vízben több milliószor jobban oldódik, mint az ezüst-klorid.
A szilárd anyagok folyadékokban való oldódása általában hőfelvétellel jár, és Le Chatelier elve szerint oldhatóságuk melegítéssel növekedjen. Ez a hatás felhasználható anyagok tisztítására átkristályosítással. Ehhez magas hőmérsékleten addig oldjuk, amíg telített oldatot nem kapunk, majd az oldatot lehűtjük, majd az oldott anyag kiválása után szűrjük. Vannak olyan anyagok (például kalcium-hidroxid, szulfát és acetát), amelyek vízben való oldhatósága a hőmérséklet emelkedésével csökken.
A szilárd anyagok, a folyadékokhoz hasonlóan, teljesen feloldódhatnak egymásban, homogén keveréket képezve - valódi szilárd oldatot, hasonlóan a folyékony oldathoz. Az egymásban részben oldódó anyagok két egyensúlyi konjugált szilárd oldatot képeznek, amelyek összetétele a hőmérséklettel változik.
Eloszlási együttható. Ha egy anyag oldatát két egymással nem elegyedő vagy részben elegyedő folyadék egyensúlyi rendszeréhez adjuk, akkor az a folyadékok között meghatározott arányban oszlik el, függetlenül az anyag teljes mennyiségétől, a rendszerben kémiai kölcsönhatások hiányában. . Ezt a szabályt eloszlási törvénynek, a folyadékokban oldott anyag koncentrációinak arányát pedig eloszlási együtthatónak nevezzük. Az eloszlási együttható megközelítőleg egyenlő egy adott anyag két folyadékban való oldhatóságának arányával, azaz. az anyag oldhatósága szerint oszlik el a folyadékok között. Ezt a tulajdonságot arra használják, hogy egy adott anyagot az egyik oldószerben lévő oldatából egy másik oldószerrel extraháljanak. Alkalmazásának másik példája az ezüst ércekből történő kinyerésének folyamata, amelyben gyakran az ólommal együtt szerepel. Ehhez cinket adnak az olvadt érchez, amely nem keveredik ólommal. Az ezüst az olvadt ólom és a cink között oszlik meg, főleg az utóbbi felső rétegében. Ezt a réteget összegyűjtik, és az ezüstöt cinkdesztillációval elválasztják.Oldhatósági termék (STB ). A felesleg (csapadék) szilárd anyag között M x B y telített oldata pedig az egyenlettel leírt dinamikus egyensúlyt hoz létreEnnek a reakciónak az egyensúlyi állandójaRemy I. Szervetlen kémia tanfolyam , vol. 1-2. M., 1963, 1966
Ma több mint 3 millió különféle anyag létezése ismert. És ez a szám évről évre növekszik, mivel a szintetikus vegyészek és más tudósok folyamatosan kísérleteket végeznek új vegyületek előállítására, amelyek hasznos tulajdonságokkal rendelkeznek.
Egyes anyagok természetes lakosok, természetes úton keletkeznek. A másik fele mesterséges és szintetikus. Mind az első, mind a második esetben azonban jelentős részt gáznemű anyagok teszik ki, amelyekre példákat és jellemzőket fogunk megvizsgálni ebben a cikkben.
Anyagok aggregált állapotai
A 17. század óta általánosan elfogadott volt, hogy minden ismert vegyület három halmazállapotban képes létezni: szilárd, folyékony és gáz halmazállapotú anyagok. Az elmúlt évtizedek gondos kutatása azonban a csillagászat, a fizika, a kémia, az űrbiológia és más tudományok területén bebizonyította, hogy létezik egy másik forma is. Ez a plazma.
Mi ő? Ez részben vagy teljesen így van. És kiderül, hogy az Univerzumban túlnyomó többségben vannak ilyen anyagok. Tehát plazma állapotban a következők találhatók:
- csillagközi anyag;
- kozmikus anyag;
- a légkör felső rétegei;
- ködök;
- sok bolygó összetétele;
- csillagok.
Ezért ma azt mondják, hogy vannak szilárd anyagok, folyadékok, gázok és plazma. Egyébként minden gáz mesterségesen átvihető ebbe az állapotba, ha ionizációnak vetik alá, azaz ionokká kényszerítik.
Gáznemű anyagok: példák
Számos példa van a vizsgált anyagokra. Hiszen a gázok a 17. század óta ismertek, amikor van Helmont természettudós először szerzett szén-dioxidot, és elkezdte tanulmányozni annak tulajdonságait. Ennek a vegyületcsoportnak egyébként ő adta a nevet is, hiszen szerinte a gázok valami rendezetlen, kaotikus, szellemekhez kötődő és láthatatlan, de kézzelfogható dolog. Ez a név Oroszországban gyökerezik.
Lehetőség van minden gáznemű anyag osztályozására, akkor könnyebb lesz példákat mondani. Végül is nehéz lefedni a sokféleséget.
Összetételük szerint megkülönböztethetők:
- egyszerű,
- összetett molekulák.
Az első csoportba azok tartoznak, amelyek bármilyen mennyiségben azonos atomokból állnak. Példa: oxigén - O 2, ózon - O 3, hidrogén - H 2, klór - CL 2, fluor - F 2, nitrogén - N 2 és mások.
- hidrogén-szulfid - H2S;
- hidrogén-klorid - HCL;
- metán - CH4;
- kén-dioxid - SO 2;
- barna gáz - NO 2;
- freon - CF 2 CL 2;
- ammónia - NH 3 és mások.

Az anyagok jellege szerinti osztályozás
A gáznemű anyagok típusait aszerint is lehet osztályozni, hogy a szerves és szervetlen világhoz tartoznak. Vagyis az azt alkotó atomok természeténél fogva. A szerves gázok a következők:
- az első öt képviselő (metán, etán, propán, bután, pentán). általános képlet C n H 2n+2 ;
- etilén - C2H4;
- acetilén vagy etilén - C 2 H 2;
- metil-amin - CH 3 NH 2 és mások.
A kérdéses vegyületekre alkalmazható másik osztályozás a bennük lévő részecskék alapján történő felosztás. Nem minden gáznemű anyag atomokból áll. Az olyan struktúrákra vonatkozó példák, amelyekben ionok, molekulák, fotonok, elektronok, Brown-részecskék és plazma vannak jelen, szintén az ilyen aggregációs állapotú vegyületekre vonatkoznak.
A gázok tulajdonságai
A vizsgált állapotú anyagok jellemzői eltérnek a szilárd vagy folyékony vegyületek jellemzőitől. A helyzet az, hogy a gáznemű anyagok tulajdonságai különlegesek. Részecskék könnyen és gyorsan mozgékonyak, az anyag egésze izotróp, vagyis a tulajdonságokat nem a készítményben lévő szerkezetek mozgási iránya határozza meg.
Lehetőség van a gáznemű anyagok legfontosabb fizikai tulajdonságainak azonosítására, amelyek megkülönböztetik őket az anyag létezésének minden más formájától.
- Olyan kapcsolatok ezek, amelyeket hétköznapi emberi eszközökkel nem lehet látni, irányítani vagy érezni. A tulajdonságok megértéséhez és egy adott gáz azonosításához négy paraméterre támaszkodnak, amelyek mindegyiket leírják: nyomás, hőmérséklet, anyagmennyiség (mol), térfogat.
- A folyadékokkal ellentétben a gázok nyom nélkül képesek elfoglalni a teljes teret, csak az edény vagy a helyiség mérete korlátozza.
- Minden gáz könnyen keveredik egymással, és ezeknek a vegyületeknek nincs határfelülete.
- Vannak könnyebb és nehezebb képviselők, így a gravitáció és az idő hatására látható az elkülönülésük.
- A diffúzió ezeknek a vegyületeknek az egyik legfontosabb tulajdonsága. Az a képesség, hogy behatoljon más anyagokba és belülről telítse őket, miközben szerkezetében teljesen rendezetlen mozgásokat hajt végre.
- A valódi gázok nem vezethetnek elektromos áramot, de ha ritka és ionizált anyagokról beszélünk, akkor a vezetőképesség meredeken növekszik.
- A gázok hőkapacitása és hővezető képessége alacsony, és fajonként eltérő.
- A viszkozitás a nyomás és a hőmérséklet növekedésével nő.
- A fázisok közötti átmenetnek két lehetősége van: párolgás - a folyadék gőzzé alakul, szublimáció - a szilárd anyag, megkerülve a folyékonyat, gázneművé válik.
A valódi gázokból származó gőzök megkülönböztető jellemzője, hogy az előbbiek bizonyos körülmények között képesek folyékony vagy szilárd fázissá alakulni, míg az utóbbiak nem. Azt is meg kell jegyezni, hogy a kérdéses vegyületek képesek ellenállni a deformációnak és folyékonyak.

A gáznemű anyagok ilyen tulajdonságai lehetővé teszik, hogy a tudomány és a technológia, az ipar és a nemzetgazdaság különböző területein széles körben alkalmazzák őket. Ezenkívül a sajátos jellemzők minden képviselő esetében szigorúan egyediek. Csak az összes valós szerkezetre jellemző jellemzőket vettük figyelembe.
Összenyomhatóság
Különböző hőmérsékleteken, valamint nyomás hatására a gázok összenyomódnak, növelve koncentrációjukat és csökkentve elfoglalt térfogatukat. Magas hőmérsékleten kitágulnak, alacsony hőmérsékleten összehúzódnak.
A változások nyomás alatt is bekövetkeznek. A gáznemű anyagok sűrűsége növekszik, és egy kritikus pont elérésekor, amely minden képviselőnél eltérő, átmenet következhet be egy másik aggregációs állapotba.

A fő tudósok, akik hozzájárultak a gázok tanulmányozásának fejlesztéséhez
Sok ilyen ember van, mert a gázok tanulmányozása munkaigényes és történelmileg hosszú folyamat. Maradjunk a leghíresebb személyiségeknél, akiknek sikerült a legjelentősebb felfedezéseket megtenniük.
- felfedezést tett 1811-ben. Nem mindegy, hogy milyen gázokról van szó, a lényeg, hogy azonos körülmények között egy térfogat molekulaszámra vonatkoztatva azonos mennyiséget tartalmazzon belőlük. Van egy számított érték, amelyet a tudós nevéről neveztek el. Ez egyenlő 6,03 * 10 23 molekulával 1 mol gázra.
- Fermi - megalkotta az ideális kvantumgáz elméletét.
- Gay-Lussac, Boyle-Marriott - azoknak a tudósoknak a neve, akik megalkották a számításokhoz szükséges alapvető kinetikai egyenleteket.
- Robert Boyle.
- John Dalton.
- Jacques Charles és sok más tudós.
A gáznemű anyagok szerkezete
A vizsgált anyagok kristályrácsának felépítésének legfontosabb jellemzője, hogy csomópontjai vagy atomokat vagy molekulákat tartalmaznak, amelyek gyenge kovalens kötésekkel kapcsolódnak egymáshoz. Van der Waals-erők is jelen vannak, amikor ionokról, elektronokról és más kvantumrendszerekről van szó.
Ezért a gázrácsok szerkezetének fő típusai a következők:
- atom;
- molekuláris.
A belső kapcsolatok könnyen megszakadnak, így ezek a kapcsolatok nem állandó alakúak, hanem a teljes tértérfogatot kitöltik. Ez magyarázza az elektromos vezetőképesség hiányát és a rossz hővezetőképességet is. A gázok azonban jó hőszigetelő képességgel rendelkeznek, mivel a diffúziónak köszönhetően képesek behatolni a szilárd anyagokba és elfoglalni a szabad klaszter tereket. Ugyanakkor a levegő nem jut át, a hő megmarad. Ez az alapja a gázok és szilárd anyagok kombinált építési célú felhasználásának.

Egyszerű anyagok a gázok között
Fentebb már tárgyaltuk, mely gázok tartoznak ebbe a kategóriába szerkezeti és szerkezeti szempontból. Ezek azok, amelyek azonos atomokból állnak. Sok példát lehet hozni, mert a nemfémek jelentős része a teljes periódusos rendszerből normál körülmények között pontosan ebben az aggregált állapotban létezik. Például:
- fehér foszfor - ennek az elemnek az egyike;
- nitrogén;
- oxigén;
- fluor;
- klór;
- hélium;
- neon;
- argon;
- kripton;
- xenon.
Ezeknek a gázoknak a molekulái lehetnek egyatomosak (nemesgázok) vagy többatomosak (ózon - O 3). A kötés típusa kovalens nempoláris, a legtöbb esetben elég gyenge, de nem mindegyikben. A kristályrács molekuláris típusú, amely lehetővé teszi, hogy ezek az anyagok könnyen átkerüljenek az egyik aggregációs állapotból a másikba. Például a jód normál körülmények között sötétlila, fémes fényű kristályok. Hevítéskor azonban élénklila gázfelhőkké szublimálódnak - I 2.

Egyébként bármilyen anyag, beleértve a fémeket is, bizonyos körülmények között gáz halmazállapotban létezhet.
Gáznemű természetű összetett vegyületek
Az ilyen gázok természetesen többségben vannak. A molekulákban lévő atomok különböző kombinációi, amelyeket kovalens kötések és van der Waals kölcsönhatások egyesítenek, lehetővé teszik a vizsgált aggregációs állapot több száz különböző képviselőjének kialakulását.
Példák a gázok közötti összetett anyagokra minden olyan vegyület, amely két vagy több különböző elemből áll. Ez a következőket foglalhatja magában:
- propán;
- bután;
- acetilén;
- ammónia;
- szilán;
- foszfin;
- metán;
- szén-diszulfid;
- a kén-dioxid;
- barna gáz;
- freon;
- etilén és mások.
Molekuláris típusú kristályrács. Sok képviselője könnyen oldódik vízben, és megfelelő savakat képez. Ezen vegyületek többsége az iparban végzett kémiai szintézisek fontos részét képezi.
A metán és homológjai
Néha a „gáz” általános fogalma természetes ásványra utal, amely túlnyomórészt szerves természetű gáznemű termékek teljes keveréke. Olyan anyagokat tartalmaz, mint:
- metán;
- etán;
- propán;
- bután;
- etilén;
- acetilén;
- pentán és néhány más.
Az iparban nagyon fontosak, mert a propán-bután keverék az a háztartási gáz, amellyel az emberek főznek, amit energia- és hőforrásként használnak fel.

Sokukat alkoholok, aldehidek, savak és más szerves anyagok szintézisére használják. Az éves földgázfelhasználás trillió köbmétert tesz ki, és ez teljesen indokolt.
Oxigén és szén-dioxid
Milyen gáznemű anyagok nevezhetők a legelterjedtebbnek és még az első osztályosok számára is ismertnek? A válasz nyilvánvaló - oxigén és szén-dioxid. Végül is ők a gázcsere közvetlen résztvevői, amely a bolygó minden élőlényében előfordul.
Köztudott, hogy az oxigénnek köszönhetően lehetséges az élet, hiszen csak bizonyos típusú anaerob baktériumok létezhetnek nélküle. A szén-dioxid pedig szükséges „élelmiszer” minden olyan növény számára, amely felszívja a fotoszintézis folyamata érdekében.
Kémiai szempontból mind az oxigén, mind a szén-dioxid fontos anyagok a vegyületek szintéziséhez. Az első erős oxidálószer, a második gyakrabban redukálószer.
Halogének
Ez egy olyan vegyületcsoport, amelyben az atomok egy gáz halmazállapotú anyag részecskéi, amelyek páronként kapcsolódnak egymáshoz kovalens, nem poláris kötésen keresztül. Azonban nem minden halogén gáz. A bróm közönséges körülmények között folyadék, a jód pedig könnyen szublimálódó szilárd anyag. A fluor és a klór az élőlények egészségére veszélyes mérgező anyagok, amelyek erős oxidálószerek, és nagyon széles körben használatosak a szintézisekben.
1. gyakorlat. Ezeket a mellékneveket illessze be pontok helyett! folyékony, szilárd, gáznemű .
2. feladat. Válaszolj a kérdésekre!
1. Milyen anyagok találhatók a természetben?
2. Milyen állapotban van a só?
3. Milyen állapotban van a bróm?
4. Milyen állapotban van a nitrogén?
5. Milyen állapotban van a hidrogén és az oxigén?
3. gyakorlat. A pontok helyett illessze be a szükséges szavakat!
1. A természetben... anyagok vannak.
2. A bróm ... állapotban van.
3. A só... anyag.
4. A nitrogén ... állapotban van.
5. A hidrogén és az oxigén... anyagok.
6. Olyan... állapotban vannak.
4. gyakorlat Hallgasd meg a szöveget! Olvasd fel hangosan.
A vegyi anyagok vízben oldódnak vagy nem oldódnak. Például a kén (S) vízben oldhatatlan. A jód (I 2) szintén nem oldódik vízben. Az oxigén (O 2) és a nitrogén (N 2) rosszul oldódik vízben. Ezek olyan anyagok, amelyek vízben gyengén oldódnak. Egyes vegyszerek jól oldódnak vízben, például a cukor.
5. feladat. Válaszolj a 4. feladat szövegében szereplő kérdésekre. Válaszaidat írd le a füzetedbe!
1. Milyen anyagok nem oldódnak vízben?
2. Milyen anyagok oldódnak jól vízben?
3. Milyen anyagokat ismer, amelyek vízben gyengén oldódnak?
6. feladat Egészítsd ki a mondatokat!
1. A vegyszerek feloldódnak vagy….
2. Néhány vegyszer jó...
3. Glükóz és szacharóz…
4. Az oxigén és a nitrogén rossz...
5. Kén és jód…
7. gyakorlat. Írj mondatokat! Használja a zárójelben lévő szavakat a megfelelő formában.
1. A só feloldódik (közönséges vízben).
2. Néhány zsír feloldódik (benzinben).
3. Az ezüst (salétromsavban) oldódik.
4. Sok fém oldódik benne (kénsav - H 2 SO 4).
5. Az üveg még (sósavban - HCl) sem oldódik.
6. Az oxigén és a nitrogén rosszul oldódik (vízben).
7. A jód jól oldódik (alkoholban vagy benzolban).
8. gyakorlat Hallgasd meg a szöveget! Olvasd fel hangosan.
Minden anyagnak vannak fizikai tulajdonságai. Fizikai tulajdonságai a szín, az íz és a szag. Például a cukor fehér színű és édes ízű. A klór (Cl 2) sárgászöld színű és erős, kellemetlen szagú. A kén (S) sárga, a bróm (Br 2) sötétvörös színű. A grafit (C) sötétszürke, a réz (Cu) pedig világos rózsaszín. A NaCl só fehér színű és sós ízű. Egyes sók keserű ízűek. A brómnak szúrós szaga van.
9. feladat. Válaszolj a 8. feladat szövegében szereplő kérdésekre. Írd le a válaszokat a füzetedbe!
1. Milyen fizikai tulajdonságokat ismer?
2. Milyen fizikai tulajdonságai vannak a cukornak?
3. Milyen fizikai tulajdonságai vannak a klórnak?
4. Milyen színű a grafit, a kén, a bróm és a réz?
5. Milyen fizikai tulajdonságai vannak a nátrium-kloridnak (NaCl)?
6. Milyen ízűek egyes sók?
7. Milyen illata van a brómnak?
10. feladat Alkoss mondatokat a modell alapján!
Minta: A nitrogén íz. Nitrogénnek nincs íze. Nitrogénnek nincs íze. A nitrogén íz nélküli anyag.
1. Nátrium-klorid - szag. -...
2. Kréta – íz és szag. -...
3. Az alkohol szín. -...
4. Víz – íz, szín és illat. -...
5. A cukor illat. -...
6. Grafit – íz és szag. –….
11. gyakorlat Mondd el, hogy az anyagoknak ugyanolyan tulajdonságaik vannak, mint a víznek.
Minta: A víz összetett anyag, az etil-alkohol is összetett anyag.
1. A víz folyékony, a salétromsav is...
2. A víz átlátszó anyag, a kénsav is...
3. A víznek nincs színe, a gyémántnak sem...
4. A víznek nincs szaga, az oxigénnek is... .
12. gyakorlat Mondd el, hogy a víznek más a tulajdonságai, mint az etil-alkoholnak.
1. Az etil-alkohol könnyű folyadék, a víz pedig...
2. Az etil-alkohol jellegzetes szagú, és a víz...
3. Az etil-alkohol forráspontja alacsony, a víz pedig...
13. gyakorlat Tisztázd az alábbi üzeneteket, használj szavakat! jellegzetes, specifikus, éles, ibolya, vörös-barna, színtelen, magas, sárga .
Minta: A bróm sötét folyadék. A bróm sötétvörös folyadék.
1. Az etil-alkoholnak szaga van. 2. A jódnak szaga van. 3. A jódgőz színes. 4. Sötét jódoldat. 5. A kénsav folyadék. 6. A kénsavnak forráspontja van. 7. A kénnek színe van.
14. gyakorlat Beszéljen az anyagok fizikai tulajdonságairól, használja a megadott szavakat, kifejezéseket!
1. Fluor (F 2) – gáz – világoszöld szín – szúrós szag – mérgező.
2. Klór (Cl 2) – gáz – sárga-zöld szín – szúrós szag – mérgező.