Zależność właściwości substancji od ich
Budynki. Wiązanie chemiczne. Podstawowy
rodzaje wiązań chemicznych.
Omówione zagadnienia:
1. Poziomy organizacji materii. Hierarchia struktury.
2. Substancje o budowie molekularnej i niemolekularnej.
3.
4. Przyczyny występowania wiązań chemicznych.
5. Wiązanie kowalencyjne: mechanizmy powstawania, metody
nakładanie się orbit atomowych, polaryzacja, moment dipolowy
Cząsteczki.
6. Wiązanie jonowe.
7. Porównanie polarnych wiązań kowalencyjnych i jonowych.
8. Porównanie właściwości substancji o kowalencyjnym polarności i
wiązania jonowe.
9. Połączenie metalowe.
10. Oddziaływania międzycząsteczkowe. Substancja (ponad 70 milionów)
Co warto wiedzieć o każdej substancji?
Formuła (z czego się składa)
Struktura (jak to działa)
Właściwości fizyczne
Właściwości chemiczne
Metody uzyskiwania
(laboratoryjne i przemysłowe)
6. Praktyczne zastosowanie
1.
2.
3.
4.
5.Hierarchia budowy materii
Wszystkie substancje
składać się z
atomy, ale nie
wszystko jest z
Cząsteczki.
Atom
Cząsteczka
Dla wszystkich substancji
Tylko dla substancji
molekularny
Budynki
Poziom nano
Dla wszystkich substancji
Wolumetryczny (makro)
poziom
Dla wszystkich substancji
Wszystkie 4 poziomy są przedmiotem nauki chemii Substancje molekularne
i niemolekularną strukturę Substancje
Molekularny
Budynki
Niemolekularny
Budynki
Składa się z cząsteczek
Złożony z atomów
lub jony
H2O, CO2, HNO3, C60,
prawie cała org. Substancje
Diament, grafit, SiO2,
metale, sole
Formuła odzwierciedla
skład cząsteczki
Formuła odzwierciedla skład
jednostka formuły Substancje
Chlorek sodu
Jednostka formuły NaCl Substancje
Krzemionka
Jednostka formuły SiO2
Muzeum Mineralogiczne Fersmana znajduje się niedaleko wejścia do Ogrodu Neskuchnego.
Adres: Moskwa, Leninsky Prospekt, budynek 18, budynek 2. Różnorodność struktur chemicznych.
gaz pędny
C5H6
Koronen
(superbenzen)
C24H12
kawitand
C36H32O8 Różnorodność struktur chemicznych.
katenan Różnorodność struktur chemicznych.
katenan Różnorodność struktur chemicznych.
Pasek Mobiusa Cząsteczka
Cząsteczka to stabilny układ składający się z kilku
jądra atomowe i elektrony.
Atomy łączą się w cząsteczki poprzez tworzenie
wiązania chemiczne.
Główną siłą napędową powstawania cząsteczki
atomy – spadek energii całkowitej.
Cząsteczki mają kształt geometryczny charakteryzujący się
odległości między jądrami i kąty między wiązaniami. Główna siła napędowa
tworzenie wiązań chemicznych
pomiędzy cząsteczkami materii -
zmniejszenie całkowitej energii
systemy. Główne rodzaje substancji chemicznych
znajomości:
1.Jonowy
2.Kowalencyjny
3.Metal
Podstawowe związki międzycząsteczkowe
interakcje:
1.Wiązania wodorowe
2. Połączenia Van der Waalsa Wiązanie jonowe
Jeśli wiązanie tworzą atomy znacznie różniące się od siebie
wartości elektroujemności (ΔOOE ≥ 1,7),
prawie całkowicie wspólną parę elektronów
przesuwa się w stronę bardziej elektroujemnego
atom.
Na kl
OEO 0,9 3,16
∆ 2,26
+Nie
Anion
:Clcation
Występujące wiązanie chemiczne pomiędzy jonami
ze względu na ich przyciąganie elektrostatyczne,
zwany jonowym. Wiązanie jonowe
Potencjał Coulomba jest kulisty
symetryczny, skierowany we wszystkich kierunkach,
dlatego wiązanie jonowe jest bezkierunkowe.
Potencjału Coulomba nie ma
ograniczenia ilościowe
dodane przeciwjony -
stąd wiązanie jonowe
nienasycony. Wiązanie jonowe
Związki z typem wiązania jonowego
stały, dobrze rozpuszczalny w
rozpuszczalniki polarne, mają wysoką zawartość
temperatury topnienia i wrzenia. Wiązanie jonowe
Krzywa I: przyciąganie jonów jeśli
czy reprezentowaliby
opłaty punktowe.
Krzywa II: odpychanie jąder w
w przypadku bliskiego sąsiedztwa jonów.
Krzywa III: minimalna energia E0 przy
odpowiada krzywej
stan równowagi jonowej
pary, w których siły
przyciąganie elektronów do jąder
kompensowane siłami
odpychanie jąder między sobą
odległość r0, Wiązanie chemiczne w cząsteczkach
Wiązania chemiczne w cząsteczkach można opisać za pomocą
pozycje dwóch metod:
- metoda wiązań walencyjnych, MBC
- metoda orbitali molekularnych, MMO Metoda wiązań walencyjnych
Teoria Heitlera-London
Podstawowe założenia metody BC:
1. Wiązanie tworzą dwa elektrony o przeciwnych wartościach
wiruje, a fale nakładają się na siebie
funkcje i gęstość elektronów pomiędzy nimi
rdzenie.
2. Połączenie zlokalizowane jest w kierunku maksimum
nakładające się Ψ-funkcje elektronów. Silniejszy
nakładać się na siebie, tym mocniejsze połączenie.
dsv – długość
komunikacja;
ESV – energia
komunikacja. Tworzenie cząsteczki wodoru:
N· + ·N → N:N
Kiedy dwa atomy się łączą
powstają siły atrakcyjne i
odpychanie:
1) przyciąganie: „jądro elektronu”
sąsiednie atomy;
2) odpychania: „rdzeń do rdzenia”,
sąsiedztwo „elektron-elektron”.
atomy. Tworzenie cząsteczki wodoru:
Molekularny
chmura dwóch elektronów,
mając maksimum
gęstość elektronów. Wiązanie chemiczne przeprowadzane powszechnie
pary elektronów nazywane są kowalencyjnymi.
Wspólną parę elektronów mogą tworzyć dwa
sposoby:
1) w wyniku połączenia dwóch niesparowanych elektronów:
2) w wyniku socjalizacji niepodzielnych
para elektronów jednego atomu (donora) i pusta
orbitale innego (akceptora).
Dwa mechanizmy tworzenia wiązań kowalencyjnych:
wymiana i dawca-akceptor.
gęstość komunikacji występuje wzdłuż linii,
łącząc centra atomów (jądra), to to
nakładanie się nazywa się sprzężeniem σ: Metody nakładania się orbitali atomowych za pomocą
utworzenie wiązania kowalencyjnego
Jeśli powstanie maksymalnej elektroniki
gęstość wiązania występuje po obu stronach
wówczas linia łącząca środki atomów (jądra).
takie nakładanie się nazywa się wiązaniem π: Wiązanie kowalencyjne polarne i niepolarne
1) Jeżeli wiązanie tworzą identyczne atomy,
dwuelektronowa chmura komunikacyjna dystrybuowana w
przestrzeń symetrycznie między ich jądrami - np
wiązanie nazywa się niepolarnym: H2, Cl2, N2.
2) jeśli wiązanie tworzą różne atomy, chmura wiązania
przesunięty w stronę atomu bardziej elektroujemnego
- takie wiązanie nazywamy polarnym: HCl, NH3, CO2. Polarne wiązanie kowalencyjne
Dipolowy moment sprzęgania
Dipol
H+δCl-δ lub H+0,18Cl-0,18
Gdzie ±δ jest skuteczne
ładunek atomowy, ułamek
absolutny ładunek
elektron.
+δ
-δ
Nie mylić ze stopniem utlenienia!
l
Iloczyn efektywnego ładunku i długości dipola
zwany momentem elektrycznym dipola: μ = δl
To jest wielkość wektorowa: skierowana od dodatniej
ładować do wartości ujemnej. Polarne wiązanie kowalencyjne
Moment dipolowy cząsteczki
Moment dipolowy cząsteczki jest równy sumie
wektory momentów dipolowych wiązań, z uwzględnieniem
samotne pary elektronów.
Jednostka momentu dipolowego
to Debye: 1D = 3,3·10-30 C·m. Polarne wiązanie kowalencyjne
Moment dipolowy cząsteczki
W iloczynie μ = δl obie wielkości są skierowane przeciwnie.
Dlatego musimy uważnie monitorować przyczynę
zmiany m.
Na przykład,
CsF
CsCl
24
31
δ „zagubiony” l
CsI
HF
HCl
HBr
CZEŚĆ
37
5,73
3,24
2,97
1,14
nawzajem Polarne wiązanie kowalencyjne
Moment dipolowy cząsteczki
Czy cząsteczka może być niepolarna, jeśli
Czy wszystkie połączenia w nim są polarne?
Cząsteczki typu AB są zawsze polarne.
Cząsteczki typu AB2 mogą być zarówno polarne, jak i
niepolarny...
H2O
O
N
CO2
μ>0
N
O
Z
μ=0
O Polarne wiązanie kowalencyjne
Cząsteczki składające się z trzech lub więcej atomów
(AB2, AB3, AB4, AB5, AB6) ,
mogą być niepolarne, jeśli są symetryczne.
Na co wpływa obecność momentu dipolowego?
Cząsteczki?
Istnieją interakcje międzycząsteczkowe i
W rezultacie zwiększa się gęstość substancji,
temperatura topnienia i temperatura wrzenia. Porównanie jonowych i kowalencyjnych wiązań polarnych
Ogólne: edukacja ogólna
para elektronów.
Różnica: stopień
ogólne przemieszczenie
para elektronów
(polaryzacja wiązania).
Wiązanie jonowe należy uważać za skrajne
w przypadku polarnego wiązania kowalencyjnego.
wiązania polarne
Wiązanie kowalencyjne: nasycone i skierowane
Nasycenie (maksymalna wartościowość) -
zdeterminowana przez zdolność atomu do tworzenia się
ograniczona liczba połączeń (biorąc pod uwagę zarówno
mechanizmy powstawania).
Kierunek wiązania jest określony przez kąt wiązania, który zależy od
rodzaj hybrydyzacji orbitali atomu centralnego.
Wiązanie jonowe: nienasycone i bezkierunkowe. Porównanie właściwości jonowych i kowalencyjnych
wiązania polarne
Kierunek wiązania jest określony przez kąty wiązania.
Kąty wiązania określa się eksperymentalnie lub
przewidywane w oparciu o teorię hybrydyzacji
Orbitale atomowe L. Paullinga lub teoria
Gillespiego.
Więcej szczegółów na ten temat na seminariach.
wiązania kowalencyjne
Wiązania kowalencyjne
Kryształy atomowe
Między atomami
w samym krysztale
Wysoka twardość
wysoka temperatura topnienia, gotowanie
zły upał i
przewodnictwo elektryczne
Kryształy molekularne
Między atomami
w cząsteczce
Umiarkowana miękkość
całkiem nisko
roztopić, zagotować
zły upał i
Przewodnictwo elektryczne
Nierozpuszczalne w wodzie Porównanie właściwości substancji jonowych i
wiązania kowalencyjne
kryształ molekularny
Temperatura topnienia 112,85 °C Porównanie właściwości substancji jonowych i
wiązania kowalencyjne
Atomowy kryształ kowalencyjny
Temperatura topnienia ≈ 3700 °C Porównanie właściwości substancji jonowych i
wiązania kowalencyjne
Wiązania jonowe
pomiędzy jonami
w krysztale
twardość i kruchość
wysoka temperatura topnienia
słaba przewodność cieplna i elektryczna
Rozpuszczalny w wodzie Porównanie właściwości substancji jonowych i
wiązania kowalencyjne
Kryształ jonowy
Temperatura topnienia ≈ 800 °C Połączenie metalowe
Wiązanie metaliczne odbywa się za pomocą elektronów,
należące do wszystkich atomów jednocześnie.
Gęstość elektronów
„gaz elektronowy” ulega delokalizacji.
Charakterystyka
metaliczny połysk
Plastikowy
Plastyczność
Wysoka temperatura i
przewodnictwo elektryczne
Temperatury topnienia
naprawdę inny. Wiązania międzycząsteczkowe.
1. Wiązanie wodorowe
Przyciąganie pomiędzy atomem wodoru (+) jednego
cząsteczka i atom F, O, N (–) innej cząsteczki
F
F
H
H
H
H
F
F
O
H3C
H
F
C
H
Polimer
(HF)n
O
C
O
H
CH3
Dimer
kwas octowy
O
Wiązania wodorowe są indywidualnie słabe,
ale silni razem Wiązania międzycząsteczkowe.
2. Wiązania wodorowe w DNA Wiązania międzycząsteczkowe.
3. Wiązania wodorowe w wodzie
woda w stanie ciekłym
lód Wiązania międzycząsteczkowe.
4. Tworzenie wiązań wodorowych w
woda
woda w stanie ciekłym
transformacja
wodę w lód Wiązania międzycząsteczkowe.
5. Powiązania Van der Waalsa
Nawet jeśli między cząsteczkami nie ma wiązań wodorowych,
cząsteczki zawsze się przyciągają.
Przyciąganie pomiędzy dipolami molekularnymi nazywa się sprzężeniem van der Waalsa.
Im silniejsza atrakcja:
1) polaryzacja; 2) wielkość molekularna.
Przykład: metan (CH4) – gaz, benzen (C6H6) – ciecz
Jedno z najsłabszych wiązań c-d-v występuje pomiędzy cząsteczkami
H2 (t.t. –259 oC, temperatura wrzenia –253 oC).
Oddziaływanie między cząsteczkami jest wielokrotnie słabsze niż wiązanie między atomami:
Ekow(Cl–Cl) = 244 kJ/mol, Evdv(Cl2–Cl2) = 25 kJ/mol
ale to właśnie zapewnia istnienie ciekłego i stałego stanu materii W wykładzie wykorzystano materiały profesora
Wydział Chemii Moskiewskiego Uniwersytetu Państwowego. Łomonosow
Eremin Wadim Władimirowicz
Dziękuję
za uwagę!
Zależność właściwości substancji od budowy cząsteczek
Lekcja otwartych umysłów
Cele. Edukacyjne – mające na celu utrwalenie i pogłębienie wiedzy studentów na temat teorii budowy chemicznej i jej podstawowych zasad.
Edukacyjny– sprzyjają tworzeniu związków i relacji przyczynowo-skutkowych.
Rozwojowy– rozwój umiejętności myślenia, umiejętności przenoszenia wiedzy i umiejętności do nowych sytuacji.
Sprzęt i odczynniki. Zestaw modeli typu ball-and-stick; próbki kauczuku naturalnego i syntetycznego, eteru dietylowego, butanolu, etanolu, fenolu, litu, sodu, roztworu lakmusowego, wody bromowej, kwasu mrówkowego i octowego.
Motto.„Każda substancja – od najprostszej do najbardziej złożonej – ma trzy różne, ale powiązane ze sobą aspekty – właściwości, skład, strukturę”(V.M. Kedrov).
PODCZAS ZAJĘĆ
Co obejmuje pojęcie „uzależnienia”? (Poznaj opinie uczniów).
Zapisz na tablicy definicję: „Uzależnienie to
1) związek jednego zjawiska z drugim jako skutek z przyczyną;
2) podporządkowanie się innym w przypadku braku niezależności, wolności” (słownik S.I. Ożegowa).
Cele lekcji ustalimy wspólnie, sporządzając diagram:
Blok motywacyjno-orientacyjny
Intelektualna rozgrzewka
Oceń poprawność poniższych stwierdzeń i poprzyj swoje odpowiedzi przykładami.
Teorię struktury chemicznej odkrył D.I. Mendelejew.
Odpowiedź. A.M.Butlerov, 1861
Wartościowość węgla w związkach organicznych może wynosić II i IV.
Odpowiedź. Wartościowość węgla jest najczęściej IV.
Atomy tworzące cząsteczki substancji organicznych są połączone losowo, bez względu na wartościowość.
Odpowiedź. Atomy w cząsteczkach są połączone w określonej kolejności, zgodnie z ich wartościowością.
Właściwości substancji nie zależą od struktury cząsteczek.
Odpowiedź. Butlerov w teorii struktury chemicznej argumentował, że o właściwościach związków organicznych decyduje skład i struktura ich cząsteczek.
Jednostka operacyjna i wykonawcza
Współczynnik struktury przestrzennej
Co wiesz o strukturze przestrzennej cząsteczek alkanów i alkenów?
Odpowiedź. W alkanach przy każdym węglu znajdują się cztery sąsiednie atomy, które znajdują się na wierzchołkach czworościanu. Sam węgiel znajduje się w środku czworościanu. Rodzaj hybrydyzacji atomów węgla – sp 3, kąty między wiązaniami (H–C–C, H–C–H, C–C–C) - 109°28”. Struktura łańcucha węglowego jest zygzakowata.
W alkenach dwa atomy węgla połączone wiązaniem podwójnym i cztery atomy wiązaniami pojedynczymi znajdują się w tej samej płaszczyźnie. Rodzaj hybrydyzacji atomowej – sp 2, kąty między wiązaniami (H–C=C, C–C=C) - 120°.
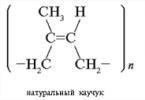
Pamiętaj o różnicy pomiędzy budową przestrzenną cząsteczek kauczuku naturalnego i kauczuku syntetycznego.
Odpowiedź. Kauczuk naturalny, liniowy polimer izoprenu, ma strukturę cis-1,4-poliizopren. Kauczuk syntetyczny może mieć strukturę trans-1,4-poliizopren.

Czy te gumy mają taką samą elastyczność?
Odpowiedź. Forma cis jest bardziej elastyczna niż forma transformacyjna. Cząsteczki kauczuku naturalnego są dłuższe i bardziej elastycznie skręcone (najpierw w spiralę, a następnie w kulkę) niż cząsteczki kauczuku syntetycznego.
Skrobia (C 5 H 10 O 5) m jest białym, amorficznym proszkiem, a celuloza (C 5 H 10 O 5) n jest substancją włóknistą.
Jaki jest powód tej różnicy?
Odpowiedź. Skrobia jest polimerem -glukozy, podczas gdy celuloza jest polimerem -glukozy.

Czy właściwości chemiczne skrobi i celulozy różnią się?
Odpowiedź. Skrobia + I 2 niebieski roztwór,
celuloza + nitroceluloza HNO 3.
Wniosek. Zarówno właściwości fizyczne, jak i chemiczne zależą od struktury przestrzennej.
Współczynnik struktury chemicznej
Jaka jest główna idea teorii struktury chemicznej?
Odpowiedź. Struktura chemiczna odzwierciedla zależność właściwości substancji od kolejności łączenia atomów i ich interakcji.
Określ, co mają wspólnego te substancje:
Odpowiedź. Mieszanina.
Porównaj właściwości fizyczne tych substancji. Jaka jest według Ciebie przyczyna tej różnicy?
Na podstawie rozkładu gęstości elektronowej wiązania chemicznego, która cząsteczka jest bardziej polarna? Z czym to się wiąże?
Odpowiedź. –OH wiązanie wodorowe.
Eksperyment demonstracyjny

Wniosek. Reaktywność alkoholu zależy od wzajemnego oddziaływania atomów w cząsteczce.
Współczynnik struktury elektronowej
Jaka jest istota wzajemnego oddziaływania atomów?
Odpowiedź. Wzajemne oddziaływanie polega na oddziaływaniu struktur elektronowych atomów, co prowadzi do przesunięcia gęstości elektronowej wiązań chemicznych.
Praca laboratoryjna
Nauczyciel. Na waszych biurkach leżą zestawy laboratoryjne. Wykonaj zadanie i udowodnij doświadczalnie zależność właściwości substancji od struktury elektronowej. Pracujcie w parach. Należy ściśle przestrzegać przepisów bezpieczeństwa.
Opcja I. Prowadzić badania właściwości chemicznych etanolu i fenolu. Udowodnić zależność ich reaktywności od struktury elektronowej. Użyj odczynników - litu metalicznego i wody bromowej. Zapisz równania możliwych reakcji. Pokaż zmianę gęstości elektronowej wiązania chemicznego w cząsteczkach.
Opcja II. Wyjaśnij istotę wzajemnego oddziaływania grupy karboksylowej –COOH i podstawnika na węglu karbonylowym w cząsteczkach kwasu karboksylowego. Rozważmy przykład kwasu mrówkowego i octowego. Użyj lakmusu i roztworu litu. Zapisz równania reakcji. Pokaż zmianę gęstości elektronowej wiązania chemicznego w cząsteczkach.
Wniosek. Właściwości chemiczne zależą od wzajemnego oddziaływania atomów.


Ostateczna kontrola wiedzy
Nauczyciel. Podsumujmy naszą lekcję. Potwierdziliśmy, że właściwości substancji zależą od przestrzennej struktury chemicznej i elektronowej.
1. Zapisz wzory HCOOH, C 6 H 5 OH i C 4 H 9 COOH w kolejności rosnących właściwości kwasowych substancji.
2. Ułóż wzory CH 3 COOH, C 3 H 7 COOH, CH 3 OH, ClCH 2 COOH w kolejności malejącej według kwasowych właściwości substancji.
3. Który aldehyd ma:

bardziej aktywna grupa aldehydowa? Dlaczego?
Oceń swoją pracę na zajęciach.
L.A.EREMINA,
nauczyciel chemii w szkole nr 24
(Abakan, Chakasja)
Kowalencyjne wiązanie chemiczne, jego odmiany i mechanizmy powstawania. Charakterystyka wiązań kowalencyjnych (biegunowość i energia wiązania). Wiązanie jonowe. Połączenie metalowe. Wiązanie wodorowe
Doktryna wiązania chemicznego stanowi podstawę całej chemii teoretycznej.
Wiązanie chemiczne jest rozumiane jako oddziaływanie atomów, które wiąże je w cząsteczki, jony, rodniki i kryształy.
Istnieją cztery rodzaje wiązań chemicznych: jonowe, kowalencyjne, metaliczne i wodorowe.
Podział wiązań chemicznych na typy jest warunkowy, ponieważ wszystkie charakteryzują się pewną jednością.
Wiązanie jonowe można uznać za skrajny przypadek polarnego wiązania kowalencyjnego.
Wiązanie metaliczne łączy kowalencyjne oddziaływanie atomów przy użyciu wspólnych elektronów i przyciąganie elektrostatyczne pomiędzy tymi elektronami i jonami metali.
Substancjom często brakuje ograniczających przypadków wiązania chemicznego (lub czystego wiązania chemicznego).
Na przykład fluorek litu $LiF$ jest klasyfikowany jako związek jonowy. W rzeczywistości wiązanie w nim jest 80% $ jonowe i 20% $ kowalencyjne. Dlatego bardziej poprawne jest oczywiście mówienie o stopniu polarności (jonowości) wiązania chemicznego.
W szeregu halogenowodorów $HF–HCl–HBr–HI–HAt$ stopień polaryzacji wiązania maleje, ponieważ zmniejsza się różnica w wartościach elektroujemności atomów halogenu i wodoru, a w wodorze astatynowym wiązanie staje się prawie niepolarne $(EO(H) = 2,1; EO(At) = 2,2)$.
W tych samych substancjach można znaleźć różne typy wiązań, np.:
- w zasadach: pomiędzy atomami tlenu i wodoru w grupach hydroksylowych wiązanie jest polarne kowalencyjne, a pomiędzy metalem a grupą hydroksylową jonowe;
- w solach kwasów zawierających tlen: między atomem niemetalu a tlenem reszty kwasowej - kowalencyjna polarna i między metalem a resztą kwasową - jonowa;
- w solach amonowych, metyloamoniowych itp.: między atomami azotu i wodoru - kowalencyjne polarne oraz pomiędzy jonami amonowymi lub metyloamoniowymi a resztą kwasową - jonowe;
- w nadtlenkach metali (na przykład $Na_2O_2$) wiązanie między atomami tlenu jest kowalencyjne niepolarne, a między metalem a tlenem jest jonowe itp.
Różne typy połączeń mogą się wzajemnie przekształcać:
— podczas dysocjacji elektrolitycznej związków kowalencyjnych w wodzie kowalencyjne wiązanie polarne zamienia się w wiązanie jonowe;
- gdy metale odparowują, wiązanie metaliczne zamienia się w niepolarne wiązanie kowalencyjne itp.
Powodem jedności wszystkich typów i typów wiązań chemicznych jest ich identyczny charakter chemiczny - oddziaływanie elektron-jądro. W każdym przypadku utworzenie wiązania chemicznego jest wynikiem oddziaływania elektronowo-jądrowego atomów, któremu towarzyszy uwolnienie energii.
Metody tworzenia wiązań kowalencyjnych. Charakterystyka wiązania kowalencyjnego: długość i energia wiązania
Kowalencyjne wiązanie chemiczne to wiązanie utworzone między atomami w wyniku tworzenia wspólnych par elektronów.
Mechanizmem powstawania takiego wiązania może być wymiana lub dawca-akceptor.
I. Mechanizm wymiany działa, gdy atomy tworzą wspólne pary elektronów, łącząc niesparowane elektrony.
1) $H_2$ - wodór:
Wiązanie powstaje w wyniku utworzenia wspólnej pary elektronów przez $s$-elektrony atomów wodoru (nakładające się na siebie $s$-orbitale):

2) $HCl$ - chlorowodór:
Wiązanie powstaje w wyniku utworzenia wspólnej pary elektronów elektronów $s-$ i $p-$ (nakładających się na orbitale $s-p-$):
3) $Cl_2$: w cząsteczce chloru powstaje wiązanie kowalencyjne z powodu niesparowanych elektronów $p-$ (nakładających się na siebie orbitali $p-p-$):

4) $N_2$: w cząsteczce azotu pomiędzy atomami tworzą się trzy wspólne pary elektronów:
II. Mechanizm dawca-akceptor Rozważmy powstawanie wiązania kowalencyjnego na przykładzie jonu amonowego $NH_4^+$.

Donor ma parę elektronów, akceptor ma pusty orbital, który ta para może zająć. W jonie amonowym wszystkie cztery wiązania z atomami wodoru są kowalencyjne: trzy powstały w wyniku utworzenia wspólnych par elektronów przez atom azotu i atomy wodoru zgodnie z mechanizmem wymiany, jedno - poprzez mechanizm donor-akceptor.
Wiązania kowalencyjne można klasyfikować na podstawie sposobu nakładania się orbitali elektronów, a także ich przemieszczenia w kierunku jednego ze związanych atomów.
Wiązania chemiczne powstałe w wyniku nakładania się orbitali elektronów wzdłuż linii wiązania nazywane są $σ$ -wiązania (wiązania sigma). Wiązanie sigma jest bardzo silne.

Orbitale $p-$ mogą nakładać się na siebie w dwóch obszarach, tworząc wiązanie kowalencyjne w wyniku bocznego nakładania się:

Wiązania chemiczne powstają w wyniku „bocznego” nakładania się orbitali elektronowych poza linią komunikacyjną, tj. w dwóch obszarach nazywane są $π$ -wiązania (wiązania pi).
Przez stopień przemieszczenia wspólne pary elektronów z jednym z atomów, które łączą, może powstać wiązanie kowalencyjne polarny I niepolarny.
Nazywa się kowalencyjne wiązanie chemiczne utworzone między atomami o tej samej elektroujemności niepolarny. Pary elektronów nie są przesunięte do żadnego z atomów, ponieważ atomy mają ten sam EO - właściwość przyciągania elektronów walencyjnych z innych atomów. Na przykład:
te. cząsteczki prostych substancji niemetalicznych powstają w wyniku kowalencyjnych wiązań niepolarnych. Nazywa się kowalencyjne wiązanie chemiczne pomiędzy atomami pierwiastków o różnej elektroujemności polarny.
Długość i energia wiązań kowalencyjnych.
Charakterystyka właściwości wiązania kowalencyjnego- jego długość i energia. Długość łącza jest odległością między jądrami atomów. Im krótsza długość wiązania chemicznego, tym jest ono silniejsze. Jednak miarą siły połączenia jest energia wiązania, która jest określona przez ilość energii potrzebnej do rozerwania wiązania. Zwykle mierzy się go w kJ/mol. Zatem, zgodnie z danymi eksperymentalnymi, długości wiązań cząsteczek $H_2, Cl_2$ i $N_2$ wynoszą odpowiednio 0,074 $, 0,198 $ i 0,109 $ nm, a energie wiązań wynoszą odpowiednio 436 $, 242 $ i 946 $ kJ/mol.
Jony. Wiązanie jonowe
Wyobraźmy sobie, że „spotykają się” dwa atomy: atom metalu z grupy I i atom niemetalu z grupy VII. Atom metalu ma pojedynczy elektron na swoim zewnętrznym poziomie energii, podczas gdy atomowi niemetalu brakuje tylko jednego elektronu, aby jego zewnętrzny poziom był kompletny.
Pierwszy atom z łatwością odda drugiemu swój elektron, który jest daleko od jądra i słabo z nim związany, a drugi zapewni mu wolne miejsce na jego zewnętrznym poziomie elektronowym.
Wtedy atom pozbawiony jednego ze swoich ładunków ujemnych stanie się cząstką naładowaną dodatnio, a druga cząstką naładowaną ujemnie pod wpływem powstałego elektronu. Takie cząstki nazywane są jony.
Wiązanie chemiczne występujące pomiędzy jonami nazywa się jonowymi.
Rozważmy powstawanie tego wiązania na przykładzie dobrze znanego związku chlorku sodu (soli kuchennej):
Proces zamiany atomów w jony przedstawia schemat:

Ta przemiana atomów w jony zawsze zachodzi podczas oddziaływania atomów typowych metali i typowych niemetali.
Rozważmy algorytm (sekwencję) rozumowania podczas rejestrowania tworzenia wiązania jonowego, na przykład między atomami wapnia i chloru:

Liczby pokazujące liczbę atomów lub cząsteczek nazywane są współczynniki i liczby pokazujące liczbę atomów lub jonów w cząsteczce nazywane są indeksy.
Połączenie metalowe
Zapoznajmy się z tym, jak atomy pierwiastków metalowych oddziałują ze sobą. Metale zwykle nie występują w postaci izolowanych atomów, ale w postaci kawałka, wlewka lub produktu metalowego. Co utrzymuje atomy metali w jednej objętości?
Atomy większości metali zawierają niewielką liczbę elektronów na poziomie zewnętrznym - 1, 2, 3 $. Elektrony te można łatwo oddzielić, a atomy stają się jonami dodatnimi. Odłączone elektrony przemieszczają się od jednego jonu do drugiego, wiążąc je w jedną całość. Łącząc się z jonami, elektrony te chwilowo tworzą atomy, po czym ponownie się rozrywają i łączą z innym jonem, itd. W rezultacie w objętości metalu atomy ulegają ciągłej przemianie w jony i odwrotnie.
Wiązanie w metalach między jonami poprzez wspólne elektrony nazywa się metalicznym.
Rysunek schematycznie przedstawia strukturę fragmentu metalu sodu.

W tym przypadku niewielka liczba wspólnych elektronów wiąże dużą liczbę jonów i atomów.

Wiązanie metaliczne ma pewne podobieństwa do wiązania kowalencyjnego, ponieważ opiera się na współdzieleniu zewnętrznych elektronów. Jednak w przypadku wiązania kowalencyjnego zewnętrzne niesparowane elektrony tylko dwóch sąsiednich atomów są wspólne, podczas gdy w przypadku wiązania metalicznego wszystkie atomy biorą udział w dzieleniu tych elektronów. Dlatego kryształy z wiązaniem kowalencyjnym są kruche, ale z wiązaniem metalowym z reguły są plastyczne, przewodzą prąd elektryczny i mają metaliczny połysk.
Wiązanie metaliczne charakteryzuje się zarówno czystymi metalami, jak i mieszaninami różnych metali – stopów w stanie stałym i ciekłym.
Wiązanie wodorowe
Wiązanie chemiczne pomiędzy dodatnio spolaryzowanymi atomami wodoru jednej cząsteczki (lub jej części) a ujemnie spolaryzowanymi atomami silnie elektroujemnych pierwiastków mających wolne pary elektronów ($F, O, N$ i rzadziej $S$ i $Cl$) innej cząsteczki (lub jego część) nazywa się wodorem.
Mechanizm tworzenia wiązań wodorowych jest częściowo elektrostatyczny, częściowo ma charakter donorowo-akceptorowy.
Przykłady międzycząsteczkowych wiązań wodorowych:
W obecności takiego połączenia nawet substancje niskocząsteczkowe mogą w normalnych warunkach być cieczami (alkohol, woda) lub łatwo skroplonymi gazami (amoniak, fluorowodór).
Substancje posiadające wiązania wodorowe mają molekularne sieci krystaliczne.
Substancje o budowie molekularnej i niemolekularnej. Rodzaj sieci krystalicznej. Zależność właściwości substancji od ich składu i struktury
Molekularna i niemolekularna budowa substancji
To nie pojedyncze atomy czy cząsteczki wchodzą w interakcje chemiczne, ale substancje. W danych warunkach substancja może znajdować się w jednym z trzech stanów skupienia: stałym, ciekłym lub gazowym. Właściwości substancji zależą także od charakteru wiązania chemicznego pomiędzy tworzącymi ją cząsteczkami – cząsteczkami, atomami czy jonami. Ze względu na rodzaj wiązania rozróżnia się substancje o budowie molekularnej i niemolekularnej.
Substancje złożone z cząsteczek nazywane są substancje molekularne. Wiązania między cząsteczkami w takich substancjach są bardzo słabe, znacznie słabsze niż między atomami wewnątrz cząsteczki i nawet w stosunkowo niskich temperaturach ulegają rozerwaniu - substancja przechodzi w ciecz, a następnie w gaz (sublimacja jodu). Temperatury topnienia i wrzenia substancji składających się z cząsteczek rosną wraz ze wzrostem masy cząsteczkowej.
Do substancji molekularnych zalicza się substancje o budowie atomowej ($C, Si, Li, Na, K, Cu, Fe, W$), wśród nich wyróżnia się metale i niemetale.
Rozważmy właściwości fizyczne metali alkalicznych. Stosunkowo niska siła wiązania między atomami powoduje niską wytrzymałość mechaniczną: metale alkaliczne są miękkie i można je łatwo ciąć nożem.
Duże rozmiary atomów prowadzą do małej gęstości metali alkalicznych: lit, sód i potas są nawet lżejsze od wody. W grupie metali alkalicznych temperatury wrzenia i topnienia maleją wraz ze wzrostem liczby atomowej pierwiastka, ponieważ Rozmiary atomów rosną, a wiązania słabną.
Do substancji niemolekularny struktury obejmują związki jonowe. Większość związków metali z niemetalami ma taką strukturę: wszystkie sole ($NaCl, K_2SO_4$), niektóre wodorki ($LiH$) i tlenki ($CaO, MgO, FeO$), zasady ($NaOH, KOH$). Substancje jonowe (niemolekularne) mają wysokie temperatury topnienia i wrzenia.
Sieci krystaliczne
Jak wiadomo, materia może występować w trzech stanach skupienia: gazowym, ciekłym i stałym.
Ciało stałe: amorficzne i krystaliczne.
Zastanówmy się, jak właściwości wiązań chemicznych wpływają na właściwości ciał stałych. Substancje stałe dzielą się na krystaliczny I amorficzny.
Substancje amorficzne nie mają wyraźnej temperatury topnienia; po podgrzaniu stopniowo miękną i zmieniają się w stan płynny. Na przykład plastelina i różne żywice są w stanie amorficznym.
Substancje krystaliczne charakteryzują się prawidłowym ułożeniem cząstek, z których się składają: atomów, cząsteczek i jonów – w ściśle określonych punktach przestrzeni. Kiedy te punkty łączą się liniami prostymi, powstaje przestrzenna struktura zwana siecią krystaliczną. Punkty, w których znajdują się cząstki kryształów, nazywane są węzłami sieci.
W zależności od rodzaju cząstek znajdujących się w węzłach sieci krystalicznej oraz charakteru połączenia między nimi wyróżnia się cztery typy sieci krystalicznych: jonowe, atomowe, molekularne I metal.
Jonowe sieci krystaliczne.
joński nazywane są sieciami krystalicznymi, w których węzłach znajdują się jony. Tworzą je substancje posiadające wiązania jonowe, które mogą wiązać zarówno jony proste $Na^(+), Cl^(-)$, jak i złożone $SO_4^(2−), OH^-$. W konsekwencji sole oraz niektóre tlenki i wodorotlenki metali mają jonowe sieci krystaliczne. Na przykład kryształ chlorku sodu składa się z naprzemiennych dodatnich jonów $Na^+$ i ujemnych jonów $Cl^-$, tworząc siatkę w kształcie sześcianu. Wiązania pomiędzy jonami w takim krysztale są bardzo trwałe. Dlatego substancje posiadające sieć jonową charakteryzują się stosunkowo dużą twardością i wytrzymałością, są ogniotrwałe i nielotne.

Atomowe sieci krystaliczne.
Atomowy nazywane są sieciami krystalicznymi, w których węzłach znajdują się pojedyncze atomy. W takich sieciach atomy są połączone ze sobą bardzo silnymi wiązaniami kowalencyjnymi. Przykładem substancji o tego typu sieciach krystalicznych jest diament, jedna z alotropowych modyfikacji węgla.
Większość substancji posiadających atomową sieć krystaliczną ma bardzo wysoką temperaturę topnienia (na przykład diament przekracza 3500°C), są mocne i twarde oraz praktycznie nierozpuszczalne.

Molekularne sieci krystaliczne.
Molekularny zwane sieciami krystalicznymi, w węzłach których znajdują się cząsteczki. Wiązania chemiczne w tych cząsteczkach mogą być zarówno polarne ($HCl, H_2O$), jak i niepolarne ($N_2, O_2$). Pomimo tego, że atomy wewnątrz cząsteczek są połączone bardzo silnymi wiązaniami kowalencyjnymi, pomiędzy samymi cząsteczkami działają słabe międzycząsteczkowe siły przyciągania. Dlatego substancje z molekularnymi sieciami krystalicznymi mają niską twardość, niską temperaturę topnienia i są lotne. Większość stałych związków organicznych ma molekularne sieci krystaliczne (naftalen, glukoza, cukier).

Metalowe sieci krystaliczne.
Substancje z wiązaniami metalicznymi mają metaliczne sieci krystaliczne. W miejscach takich sieci znajdują się atomy i jony (albo atomy, albo jony, w które atomy metali łatwo przekształcają się, oddając swoje zewnętrzne elektrony „do powszechnego użytku”). Ta wewnętrzna struktura metali determinuje ich charakterystyczne właściwości fizyczne: ciągliwość, ciągliwość, przewodność elektryczną i cieplną, charakterystyczny metaliczny połysk.
Elektroujemność to właściwość pierwiastka chemicznego polegająca na przyciąganiu do swojego atomu elektronów z atomów innych pierwiastków, z którymi pierwiastek ten tworzy wiązanie chemiczne w związkach.
Kiedy między atomami różnych pierwiastków tworzy się wiązanie chemiczne, wspólna chmura elektronów przesuwa się w stronę atomu bardziej elektroujemnego, dlatego wiązanie staje się kowalencyjnie polarne, a jeśli różnica elektroujemności jest duża, staje się jonowe.
Elektroujemność jest brana pod uwagę przy pisaniu wzorów chemicznych: w związkach binarnych symbol najbardziej elektroujemnego pierwiastka jest zapisany z tyłu.
Elektroujemność wzrasta od lewej do prawej dla elementów każdego okresu i maleje od góry do dołu dla elementów tej samej grupy PS.
Wartościowość Pierwiastek to właściwość jego atomów polegająca na łączeniu się z pewną liczbą innych atomów.
Wyróżnia się wartościowość stechiometryczną, elektroniczną i liczbę koordynacyjną. Rozważymy tylko wartościowość stechiometryczną.
Stechiometryczny Wartościowość pokazuje, ile atomów innego pierwiastka jest przyłączonych do atomu danego pierwiastka. Wartościowość wodoru przyjmuje się jako jednostkę wartościowości, ponieważ wodór jest zawsze jednowartościowy. Na przykład w związkach HCl, H 2 O, NH 3 (poprawna pisownia amoniaku H 3 N jest już używana we współczesnych podręcznikach), chlor CH 4 jest jednowartościowy, tlen jest dwuwartościowy, azot jest trójwartościowy, a węgiel jest czterowartościowy.
Wartościowość stechiometryczna tlenu wynosi zwykle 2. Ponieważ prawie wszystkie pierwiastki tworzą związki z tlenem, wygodnie jest zastosować ją jako standard do określania wartościowości innego pierwiastka. Na przykład w związkach Na2O, CoO, Fe2O3, SO3 sód jest jednowartościowy, kobalt jest dwuwartościowy, żelazo jest trójwartościowe, siarka jest sześciowartościowa.
W reakcjach redoks ważne będzie dla nas określenie stopni utlenienia pierwiastków.
Stan utlenienia pierwiastka w substancji nazywa się jego wartościowością stechiometryczną, przyjmowaną ze znakiem plus lub minus.
Pierwiastki chemiczne dzielą się na pierwiastki o stałej wartościowości i pierwiastki o zmiennej wartościowości.
1.3.3. Substancje o budowie molekularnej i niemolekularnej. Rodzaj sieci krystalicznej. Zależność właściwości substancji od ich składu i struktury.
W zależności od stanu, w jakim związki występują w przyrodzie, dzieli się je na molekularne i niemolekularne. W substancjach molekularnych najmniejszymi cząsteczkami strukturalnymi są cząsteczki. Substancje te mają molekularną sieć krystaliczną. W substancjach niemolekularnych najmniejszymi cząsteczkami strukturalnymi są atomy lub jony. Ich sieć krystaliczna jest atomowa, jonowa lub metaliczna.
Rodzaj sieci krystalicznej w dużej mierze determinuje właściwości substancji. Na przykład metale posiadające typ siatki metalowej, różniący się od wszystkich innych elementów wysoka ciągliwość, przewodność elektryczna i cieplna. Te właściwości, a także wiele innych - plastyczność, metaliczny połysk itp. powstają w wyniku specjalnego rodzaju wiązania pomiędzy atomami metali - połączenie metalowe. Należy zauważyć, że właściwości właściwe metalom pojawiają się tylko w stanie skondensowanym. Na przykład srebro w stanie gazowym nie ma właściwości fizycznych metali.
Specjalny rodzaj wiązania w metalach – metaliczne – wynika z niedoboru elektronów walencyjnych, dlatego są one wspólne dla całej struktury metalu. Najprostszy model budowy metali zakładał, że sieć krystaliczna metali składa się z jonów dodatnich otoczonych wolnymi elektronami, ruch elektronów odbywa się chaotycznie, podobnie jak cząsteczki gazu. Jednak taki model, choć jakościowo wyjaśniający wiele właściwości metali, okazuje się niewystarczający w badaniach ilościowych. Dalszy rozwój teorii stanu metalicznego doprowadził do powstania pasmowa teoria metali, który opiera się na koncepcjach mechaniki kwantowej.
Miejsca sieci krystalicznej zawierają kationy i atomy metali, a elektrony poruszają się swobodnie po sieci krystalicznej.
Charakterystyczną właściwością mechaniczną metali jest Plastikowy, ze względu na specyfikę wewnętrznej struktury ich kryształów. Przez plastyczność rozumie się zdolność ciał pod wpływem sił zewnętrznych do odkształcenia, które utrzymuje się nawet po ustaniu oddziaływania czynników zewnętrznych. Ta właściwość metali pozwala na nadawanie im różnych kształtów podczas kucia, metal można zwijać w arkusze lub rozciągać na drut.
Plastyczność metali wynika z faktu, że pod wpływem czynników zewnętrznych warstwy jonów tworzących sieć krystaliczną przesuwają się względem siebie bez pękania. Dzieje się tak na skutek tego, że przemieszczone elektrony, dzięki swobodnej redystrybucji, w dalszym ciągu komunikują się pomiędzy warstwami jonowymi. Kiedy substancja stała posiadająca sieć atomową poddawana jest działaniu mechanicznemu, jej poszczególne warstwy ulegają przesunięciu, a przyczepność między nimi zostaje zakłócona na skutek zerwania wiązań kowalencyjnych.
jony, wówczas powstają te substancje jonowy typ sieci krystalicznej.


Są to sole, a także tlenki i wodorotlenki typowych metali. Są to twarde, kruche substancje, ale ich główną cechą jest : roztwory i stopy tych związków przewodzą prąd elektryczny.
Jeśli węzły sieci krystalicznej zawierają atomy, wówczas powstają te substancje atomowy typ sieci krystalicznej(diament, bor, krzem, glin i tlenki krzemu). Właściwości są bardzo twarde i ogniotrwałe, nierozpuszczalne w wodzie.
Jeśli węzły sieci krystalicznej zawierają Cząsteczki, wówczas powstają te substancje (w normalnych warunkach gazy i ciecze: O 2, HCl; I 2 substancje organiczne).
Ciekawostką jest metaliczny gal, który topi się w temperaturze 30 o C. Anomalię tę tłumaczy się faktem, że cząsteczki Ga 2 znajdują się w węzłach sieci krystalicznej, a ich właściwości stają się podobne do substancji o charakterze molekularnym sieci krystalicznej.

Przykład. Wszystkie niemetale z grupy mają strukturę niemolekularną:
1) węgiel, bor, krzem; 2) fluor, brom, jod;
3) tlen, siarka, azot; 4) chlor, fosfor, selen.
W substancjach niemolekularnych najmniejszymi cząsteczkami strukturalnymi są atomy lub jony. Ich sieć krystaliczna jest atomowa, jonowa lub metaliczna
Na decyzjaŁatwiej podejść do tego pytania od drugiej strony. Jeśli węzły sieci krystalicznej zawierają Cząsteczki, wówczas powstają te substancje molekularny typ sieci krystalicznej(w normalnych warunkach gazy i ciecze: O 2, HCl; także I 2, rombowa siarka S 8, biały fosfor P 4, substancje organiczne). Pod względem właściwości są to związki kruche, topliwe.
Druga odpowiedź zawiera gazowy fluor, trzecia zawiera tlen i azot, a czwarta zawiera chlor gazowy. Oznacza to, że substancje te mają molekularną sieć krystaliczną i strukturę molekularną.
W Pierwszy Odpowiedź jest taka, że wszystkie substancje w zwykłych warunkach są związkami stałymi i tworzą sieć atomową, co oznacza, że mają strukturę niemolekularną.
Poprawna odpowiedź:1) węgiel, bor, krzem
Wykład: Substancje o budowie molekularnej i niemolekularnej. Rodzaj sieci krystalicznej. Zależność właściwości substancji od ich składu i struktury
Substancje molekularne i niemolekularne
Ze względu na swoją strukturę substancje chemiczne dzielą się na dwie grupy: nazywane są tymi, które składają się z cząsteczek molekularny i zawierające atomy i jony – niemolekularny.
Substancje molekularne mają niskie temperatury topnienia/wrzenia. Mogą występować w trzech stanach skupienia: ciekłym, stałym i gazowym. Do tej grupy zalicza się większość prostych substancji niemetali, a także ich związki między sobą. Wiązania między atomami substancji molekularnych są kowalencyjne.
Substancje niemolekularne mają wysokie temperatury topnienia/wrzenia. Są w stanie stałym. Są to, jak się domyślacie, proste substancje metaliczne, ich związki z niemetalami, do niemetali zaliczają się bor, węgiel - diament, fosfor (czarny i czerwony), krzem. Substancje niemolekularne tworzą kryształy jonowe, atomowe i molekularne, których układ cząstek ma wyraźną sekwencję i tworzy siatkę.
Rodzaje sieci krystalicznych
Wyróżnia się cztery typy sieci krystalicznych, w zależności od rodzaju cząstek znajdujących się w węzłach sieci:

1) Jonowysieć krystaliczna jest charakterystyczna dla związków z jonowym typem wiązania chemicznego. Kationy i aniony znajdują się w miejscach sieci. Przykładami substancji o tego typu sieci krystalicznej są sole, tlenki i wodorotlenki typowych metali. Są to substancje twarde, ale kruche. Charakteryzują się ogniotrwałością. Rozpuszczają się w wodzie i przewodzą prąd elektryczny.

2) Energia jądrowa sieć ma atomy w swoich węzłach. Cząstki tworzą kowalencyjne wiązania niepolarne i polarne. Spośród substancji prostych ten typ sieci krystalicznej należy do węgla w postaci grafitu i diamentu, boru, krzemu i germanu. Spośród substancji złożonych, na przykład tlenek krzemu (kwarc, kryształ górski) ma sieć atomową. Są to bardzo twarde, ogniotrwałe substancje, niezbyt powszechne w przyrodzie. Nie rozpuszczają się w wodzie.

3) Molekularny Sieć krystaliczna zbudowana jest z cząsteczek utrzymywanych razem przez słabe siły przyciągania międzycząsteczkowego. Dlatego substancje tego typu sieci charakteryzują się niską twardością, kruchością i niską temperaturą topnienia. Na przykład jest to woda w stanie lodowym. Większość stałych związków organicznych ma tego typu sieć. Rodzaj wiązania w związku jest kowalencyjny.