4. Natura i rodzaje wiązań chemicznych. Wiązanie kowalencyjne
Aplikacja. Struktura przestrzenna cząsteczek
Każda cząsteczka (na przykład CO 2, H 2 O, NH 3) lub jon molekularny (na przykład CO 3 2 -, H 3 O +, NH 4 +) ma określony skład jakościowy i ilościowy, a także strukturę ( geometria). Geometria cząsteczki powstaje w wyniku ustalonego względnego rozmieszczenia atomów i wartości kątów wiązania.
Kąt wiązania to kąt pomiędzy wyimaginowanymi liniami prostymi przechodzącymi przez jądra atomów związanych chemicznie. Można również powiedzieć, że jest to kąt między dwiema liniami wiązań, które mają wspólny atom.
Linia wiązania to linia łącząca jądra dwóch chemicznie związanych atomów.
Jedynie w przypadku cząsteczek dwuatomowych (H 2, Cl 2 itp.) nie pojawia się kwestia ich geometrii - są one zawsze liniowe, tj. jądra atomów znajdują się na tej samej linii prostej. Struktura bardziej złożonych cząsteczek może przypominać różne kształty geometryczne, na przykład:
- cząsteczki trójatomowe i jony typu AX 2 (H 2 O, CO 2, BeCl 2)

- cząsteczki tetraatomowe i jony typu AX 3 (NH 3, BF 3, PCl 3, H 3 O +, SO 3) lub A 4 (P 4, As 4)

- cząsteczki pentaatomowe i jony typu AX 4 (CH 4, XeF 4, GeCl 4)

Istnieją cząstki o bardziej złożonej strukturze (ośmiościan, bipiramida trygonalna, płaski sześciokąt foremny). Ponadto cząsteczki i jony mogą mieć kształt zniekształconego czworościanu, nieregularnego trójkąta; w cząsteczkach o budowie kątowej wartości α mogą być różne (90°, 109°, 120°).
Strukturę cząsteczek można wiarygodnie ustalić eksperymentalnie, stosując różne metody fizyczne. Aby wyjaśnić przyczyny powstawania określonej struktury i przewidzieć geometrię cząsteczek, opracowano różne modele teoretyczne. Najłatwiejsze do zrozumienia są model odpychania par elektronów walencyjnych (model OVEP) i model hybrydyzacji orbitali atomowych walencyjnych (model GVAO).
Podstawą wszystkich (w tym dwóch wymienionych) modeli teoretycznych wyjaśniających budowę cząsteczek jest następujące twierdzenie: stan stabilny cząsteczki (jonu) odpowiada przestrzennemu układowi jąder atomowych, w którym następuje wzajemne odpychanie elektronów w wartościowości warstwa jest minimalna.
Uwzględnia to odpychanie elektronów zarówno uczestniczących w tworzeniu wiązania chemicznego (elektrony wiążące), jak i tych, które nie uczestniczą (samotne pary elektronów). Bierze się pod uwagę, że orbital wiążącej pary elektronów jest zwarty skupiony pomiędzy dwoma atomami i dlatego zajmuje mniej miejsca niż orbital wolnej pary elektronów. Z tego powodu odpychający efekt niewiążącej (samotnej) pary elektronów i jej wpływ na kąty wiązania jest bardziej wyraźny niż w przypadku pary wiążącej.
model OWEP. Teoria ta opiera się na następujących podstawowych zasadach (wyrażonych w uproszczeniu):
- o geometrii cząsteczki decydują tylko wiązania σ (ale nie π-);
- Kąty między wiązaniami zależą od liczby wolnych par elektronów w atomie centralnym.
Przepisy te należy rozpatrywać łącznie, ponieważ zarówno elektrony wiązania chemicznego, jak i samotne pary elektronów odpychają się, co ostatecznie prowadzi do powstania struktury molekularnej, w której to odpychanie jest minimalne.
Rozważmy geometrię niektórych cząsteczek i jonów z punktu widzenia metody OVEP; elektrony wiązania σ będą oznaczone dwiema kropkami (:), pojedyncze pary elektronów symbolem konwencjonalnym ( lub ) lub myślnikiem.
Zacznijmy od pięcioatomowej cząsteczki metanu CH 4. W tym przypadku atom centralny (ten węgiel) całkowicie wyczerpał swoje możliwości walencyjne i nie zawiera samotnych par elektronów walencyjnych, tj. wszystkie cztery elektrony walencyjne tworzą cztery wiązania σ. Jak powinny być ustawione względem siebie elektrony wiązania σ, aby odpychanie między nimi było minimalne? Oczywiście pod kątem 109°, tj. wzdłuż linii skierowanych do wierzchołków wyimaginowanego czworościanu, w środku którego znajduje się atom węgla. W tym przypadku elektrony biorące udział w tworzeniu wiązania są jak najbardziej od siebie oddalone (dla konfiguracji kwadratowej odległość między tymi elektronami wiązania jest większa, a odpychanie międzyelektronowe mniejsze). Z tego powodu cząsteczka metanu, a także cząsteczki CCl 4, CBr 4, CF 4 mają kształt foremnego czworościanu (mówią, że mają strukturę czworościenną):

Kation amonowy NH + 4 i anion BF 4 - mają tę samą budowę, ponieważ atomy azotu i boru tworzą każdy po cztery wiązania σ i nie mają wolnych par elektronów.
Rozważmy strukturę tetraatomowej cząsteczki amoniaku NH 3. Cząsteczka amoniaku ma trzy pary elektronów wiążących i jedną samotną parę elektronów na atomie azotu, tj. także cztery pary elektronów. Czy jednak kąt wiązania pozostanie na poziomie 109°? Nie, gdyż samotna para elektronów, zajmująca większą objętość w przestrzeni, działa silnie odpychająco na elektrony wiązania σ, co powoduje nieznaczne zmniejszenie kąta wiązania, w tym przypadku kąt ten wynosi około 107°. Cząsteczka amoniaku ma kształt piramidy trygonalnej (struktura piramidalna):

Czteratomowy jon hydroniowy H 3 O + ma również strukturę piramidalną: atom tlenu tworzy trzy wiązania σ i zawiera jedną samotną parę elektronów.
W czteroatomowej cząsteczce BF 3 liczba wiązań σ również wynosi trzy, ale atom boru nie ma samotnych par elektronów. Oczywiście odpychanie międzyelektronowe będzie minimalne, jeśli cząsteczka BF 3 będzie miała kształt regularnego płaskiego trójkąta o kącie wiązania 120°:

Cząsteczki BCl 3, BH 3, AlH 3, AlF 3, AlCl 3, SO 3 mają tę samą strukturę i z tych samych powodów.
Jaką strukturę będzie miała cząsteczka wody?
Trójatomowa cząsteczka wody ma cztery pary elektronów, ale tylko dwie z nich to elektrony z wiązaniami σ, pozostałe dwie to wolne pary elektronów atomu tlenu. Działanie odpychające dwóch wolnych par elektronów w cząsteczce H 2 O jest silniejsze niż w cząsteczce amoniaku z jedną wolną parą, dlatego kąt wiązania H–O–H jest mniejszy niż kąt H–N–H w cząsteczce amoniaku : w cząsteczce wody kąt wiązania wynosi około 105° :

Cząsteczka CO 2 (O=C=O) również posiada dwie pary elektronów wiążących (rozważamy tylko wiązania σ), jednakże w przeciwieństwie do cząsteczki wody, atom węgla nie posiada wolnych par elektronów. Oczywiście odpychanie między parami elektronów w tym przypadku będzie minimalne, jeśli będą one ustawione pod kątem 180°, tj. z liniową formą cząsteczki CO 2:
Cząsteczki BeH 2, BeF 2, BeCl 2 mają podobną strukturę i z tych samych powodów. W trójatomowej cząsteczce SO 2 atom centralny (atom siarki) również tworzy dwa wiązania σ, ale ma wolną parę elektronów, dlatego cząsteczka tlenku siarki(IV) ma budowę kątową, ale kąt w niej wiązania jest większy niż w cząsteczce wody (atom tlenu dwie wolne pary elektronów, a atom siarki tylko jedną):

Niektóre cząsteczki trójatomowe składu ABC (na przykład H–C≡N, Br–C≡N, S=C=Te, S=C=O) również mają strukturę liniową, w której centralny atom nie ma samotnego pary elektronów. Ale cząsteczka HClO ma strukturę kątową (α ≈ 103°), ponieważ atom centralny, atom tlenu, zawiera dwie wolne pary elektronów.
Wykorzystując model OVEP można także przewidzieć strukturę cząsteczek substancji organicznych. Na przykład w cząsteczce acetylenu C2H2 każdy atom węgla tworzy dwa wiązania σ, a atomy węgla nie mają wolnych par elektronów; dlatego cząsteczka ma strukturę liniową H – C≡C – H.
W cząsteczce etenu C 2 H 4 każdy atom węgla tworzy trzy wiązania σ, co przy braku wolnych par elektronów na atomach węgla prowadzi do trójkątnego układu atomów wokół każdego atomu węgla:
W tabeli 4.2 podsumowuje niektóre dane dotyczące struktury cząsteczek i jonów.
Tabela 4.2
Zależność pomiędzy strukturą cząsteczek (jonów) a liczbą σ -wiązania i wolne pary elektronów atomu centralnego
| Rodzaj cząsteczki (jon) | Liczba wiązań σ utworzonych przez atom centralny | Liczba wolnych par elektronów | Struktura, kąt wiązania | Przykłady cząstek (podświetlony atom centralny) |
|---|---|---|---|---|
| AB 2 | 2 | 0 | Liniowy, α = 180° | CO 2 , Be H 2 , HC N , Be Cl 2 , C 2 H 2 , N 2 O , CS 2 |
| 1 | Kątowy, 90°< α < 120° | SnCl 2, S O 2, N O 2 - | ||
| 2 | Kątowy, α< 109° | H. 2 O , O fa 2 , H 2 S , H 2 Se , S fa 2 , Xe O 2 , - | ||
| AB 3 | 3 | 0 | Trójkątny, α ≈ 120° | B fa 3, b H 3, B Cl 3, Al F 3, S O 3, do O 3 2 -, N O 3 - |
| 1 | Piramida trygonalna, α< 109° | N H. 3 , H. 3 O + , N fa 3 , S O 3 2 - , P. fa 3 , P. Cl 3 , As H 3 | ||
| AB 4 | 4 | 0 | Czworościan, α = 109° | N H. 4 + , CH 4 , Si H. 4 , b fa 4 , b H. 4 - , S O 4 2 - , ZA l H. 4 - |
model GVAO. Głównym stanowiskiem tego modelu jest to, że w tworzeniu wiązań kowalencyjnych nie biorą udziału „czyste” orbitale walencyjne s -, p - i d - ale tzw. orbitale hybrydowe. Następnie rozważa się hybrydyzację obejmującą tylko 2p- i 2s-AO.
Hybrydyzacja to zjawisko mieszania się orbitali walencyjnych, w wyniku czego wyrównują się one pod względem kształtu i energii.
Pojęcie hybrydyzacji stosuje się zawsze wtedy, gdy w tworzeniu wiązań chemicznych biorą udział elektrony o różnych podpoziomach energii, które nie różnią się zbytnio energią: 2s i 2p, 4s, 4p i 3d itp.
Orbital hybrydowy nie ma kształtu podobnego do oryginalnych 2p- i 2s-AO. Ma kształt nieregularnej trójwymiarowej ósemki:
Jak widać, hybrydowe AO są bardziej wydłużone, dzięki czemu mogą lepiej się nakładać i tworzyć silniejsze wiązania kowalencyjne. Kiedy orbitale hybrydowe nakładają się, powstają tylko wiązania σ; Ze względu na swój specyficzny kształt, hybrydowe AO nie biorą udziału w tworzeniu wiązań π (tylko niehybrydowe AO tworzą wiązania π). Liczba orbitali hybrydowych jest zawsze równa liczbie początkowych AO uczestniczących w hybrydyzacji. Orbitale hybrydowe muszą być zorientowane w przestrzeni w taki sposób, aby zapewnić ich maksymalną odległość od siebie. W takim przypadku odpychanie znajdujących się na nich elektronów (wiążących i niewiążących) będzie minimalne; energia całej cząsteczki również będzie minimalna.
Model GVAO zakłada, że hybrydyzacja obejmuje orbitale o podobnych wartościach energii (tj. orbitali walencyjnych) i odpowiednio dużej gęstości elektronowej. Gęstość elektronowa orbitalu maleje wraz ze wzrostem jego rozmiaru, dlatego rola w hybrydyzacji jest szczególnie znacząca w przypadku cząsteczek pierwiastków o małych okresach.
Należy pamiętać, że GAO nie jest rzeczywistym zjawiskiem fizycznym, ale wygodnym pojęciem (modelem matematycznym), które pozwala nam opisać strukturę niektórych cząsteczek. Tworzenie się hybrydowych AO nie jest wykrywane żadnymi metodami fizycznymi. Niemniej jednak teoria hybrydyzacji ma pewne uzasadnienie fizyczne.
Rozważmy strukturę cząsteczki metanu. Wiadomo, że cząsteczka CH4 ma kształt foremnego czworościanu z atomem węgla w środku; wszystkie cztery wiązania C–H powstają w wyniku mechanizmu wymiany i mają tę samą energię i długość, tj. są równoważne. Dość prosto wytłumaczyć obecność czterech niesparowanych elektronów w atomie węgla, zakładając jego przejście do stanu wzbudzonego:

Jednak proces ten w żaden sposób nie wyjaśnia równoważności wszystkich czterech wiązań C–H, gdyż zgodnie z powyższym schematem trzy z nich powstają z udziałem 2p-AO atomu węgla, jedno z udziałem 2s-AO, a kształt i energia 2p i 2s-AO są różne.
Aby wyjaśnić ten i inne podobne fakty, L. Pauling opracował koncepcję GVAO. Zakłada się, że mieszanie orbitali następuje w momencie tworzenia się wiązań chemicznych. Proces ten wymaga nakładu energii na parowanie elektronów, który jednak jest kompensowany przez uwolnienie energii, gdy hybrydowe AO tworzą silniejsze (w porównaniu z niehybrydowymi) wiązania.
W oparciu o charakter i liczbę AO biorących udział w hybrydyzacji wyróżnia się kilka typów.
W przypadku hybrydyzacji sp 3 mieszane są orbitale jeden s i trzy p (stąd nazwa rodzaju hybrydyzacji). W przypadku atomu węgla proces można przedstawić w następujący sposób:
1 s 2 2 s 2 2 p x 1 2 p y 1 → przejście elektronu 1 s 2 2 s 1 2 p x 1 2 p y 1 2 p z 1 → hybrydyzacja 1 s 2 2 (s p 3) 4
lub za pomocą konfiguracji elektronicznych:

Cztery hybrydowe AO sp 3 zajmują pozycję pośrednią pod względem energii pomiędzy AO 2p i 2s.
Schemat hybrydyzacji sp 3 można przedstawić za pomocą obrazów kształtu AO atomu węgla:

Zatem w wyniku hybrydyzacji sp 3 powstają cztery orbitale hybrydowe, z których każdy zawiera niesparowany elektron. Orbitale te rozmieszczone są w przestrzeni pod kątem 109°28′, co zapewnia minimalne odpychanie znajdujących się na nich elektronów. Jeśli połączysz wierzchołki orbitali hybrydowych, otrzymasz trójwymiarową figurę - czworościan. Z tego powodu cząsteczki o składzie AX 4 (CH 4, SiH 4, CCl 4 itp.), w których realizowany jest tego typu hybrydyzacja, mają kształt czworościanu.
Koncepcja hybrydyzacji sp 3 AO dobrze wyjaśnia również strukturę cząsteczek H 2 O i NH 3. Zakłada się, że w hybrydyzacji biorą udział 2s - i 2p -AO atomów azotu i tlenu. W tych atomach liczba elektronów walencyjnych (odpowiednio 5 i 6) przekracza liczbę hybrydowych AO sp 3 (4), dlatego niektóre hybrydowe AO zawierają niesparowane elektrony, a niektóre zawierają wolne pary elektronów:

Widzimy, że w atomie azotu samotna para elektronów znajduje się na jednym hybrydowym AO, a w atomie tlenu - na dwóch. W tworzeniu wiązań z atomami wodoru uczestniczą tylko AO z niesparowanymi elektronami, a samotne pary elektronów będą działać odpychająco (ryc. 4.5) na siebie (w przypadku tlenu) i na wiążące elektrony (dla tlenu i azotu) ).

Ryż. 4,5. Schemat odpychającego działania orbitali wiążących i niewiążących w cząsteczce amoniaku (a) i wody (b)
Odpychanie jest silniejsze w przypadku cząsteczki wody. Ponieważ atom tlenu ma dwie wolne pary elektronów, odchylenie od idealnego kąta wiązania dla tego typu hybrydyzacji (109°28′) w cząsteczce wody jest większe niż w cząsteczce amoniaku (w cząsteczkach H2O i NH3 kąt wiązania wynosi 104, odpowiednio 5° i 107°).
Model hybrydyzacji sp 3 służy do wyjaśnienia budowy diamentu, krzemu, jonów NH 4 + i H 3 O +, alkanów, cykloalkanów itp. W przypadku węgla ten rodzaj hybrydyzacji stosuje się zawsze, gdy atom tego pierwiastek tworzy tylko wiązania σ.
W przypadku hybrydyzacji sp 2, miesza się jeden orbital s i dwa p. Rozważmy ten typ hybrydyzacji na przykładzie atomu boru. Proces jest reprezentowany za pomocą diagramów energetycznych


Zatem w wyniku hybrydyzacji sp 2 orbitali walencyjnych atomu boru powstają trzy hybrydowe AO, skierowane pod kątem 120°, a jeden z orbitali 2p nie bierze udziału w hybrydyzacji. Orbitale hybrydowe zawierają jeden niesparowany elektron, znajdują się w tej samej płaszczyźnie, a jeśli połączymy ich wierzchołki, otrzymamy regularny trójkąt. Z tego powodu cząsteczki o składzie AX 3 z hybrydyzacją sp 2 orbitali atomu A mają budowę trójkątną, co pokazano dla cząsteczki BF 3:

Niehybrydowy 2p-AO atomu boru jest wolny (niezajęty) i zorientowany prostopadle do płaszczyzny wiązań B–F, dlatego cząsteczka BF 3 jest akceptorem elektronów podczas tworzenia wiązania kowalencyjnego zgodnie z mechanizmem donor-akceptor, gdy interakcji z cząsteczką amoniaku.
Pojęcie hybrydyzacji sp 2 służy do wyjaśnienia natury podwójnego wiązania węgiel-węgiel w alkenach, budowy benzenu i grafitu, tj. w przypadkach, gdy atom węgla tworzy trzy wiązania σ i jedno π.
Przestrzenny układ orbitali atomu węgla dla hybrydyzacji sp 2 wygląda następująco: niehybrydowy 2p AO jest zorientowany prostopadle do płaszczyzny, w której znajdują się orbitale hybrydowe (zarówno hybrydowe, jak i niehybrydowe AO zawierają niesparowany elektron) .

Rozważmy tworzenie wiązań chemicznych w cząsteczce etylenu H 2 C=CH 2. W nim hybrydowe AO nakładają się na siebie oraz na 1s-AO atomu wodoru, tworząc pięć wiązań σ: jedno C – C i cztery C – H. Niehybrydowe 2p-AO nakładają się bocznie i tworzą wiązanie π pomiędzy atomami węgla (ryc. 4.6).

Ryż. 4.6. Schemat tworzenia wiązań σ (a) i wiązania π (b) w cząsteczce etylenu
W przypadku hybrydyzacji sp, jeden orbital s i jeden p są mieszane. Rozważmy ten typ hybrydyzacji na przykładzie atomu berylu. Wyobraźmy sobie proces hybrydyzacji za pomocą diagramu energii:

oraz z obrazem kształtu orbitali
Zatem w wyniku hybrydyzacji sp powstają dwa hybrydowe AO, każdy zawierający jeden niesparowany elektron. Dwa 2p-AO nie biorą udziału w hybrydyzacji i w przypadku berylu pozostają wolne. Orbitale hybrydowe są zorientowane pod kątem 180°, dlatego cząsteczki typu AX 2 z hybrydyzacją sp orbitali atomu A mają strukturę liniową (ryc. 4.7).

Ryż. 4.7. Struktura przestrzenna cząsteczki BeCl 2
Wykorzystując model sp-hybrydyzacji orbitali atomu węgla, wyjaśniono naturę potrójnego wiązania w cząsteczkach alkinów. W tym przypadku dwa hybrydowe i dwa niehybrydowe 2p-AO (pokazane poziomymi strzałkami →, ←) zawierają niesparowany elektron:

W cząsteczce acetylenu HC≡CH dzięki hybrydowym AO powstają wiązania σ C–H i C–C:

Hybrydowe 2p-AO nakładają się na siebie w dwóch prostopadłych płaszczyznach i tworzą dwa wiązania π pomiędzy atomami węgla (ryc. 4.8).

Ryż. 4.8. Schematyczne przedstawienie wiązań π (a) i płaszczyzn wiązań π (b) w cząsteczce acetylenu (falista linia pokazuje boczne nakładanie się 2p-AO atomu węgla)
Koncepcja sp-hybrydyzacji orbitali atomu węgla pozwala wyjaśnić powstawanie wiązań chemicznych w cząsteczkach karbinu, CO i CO 2, propadienu (CH 2 = C = CH 2), tj. we wszystkich przypadkach, w których atom węgla tworzy dwa wiązania σ i dwa wiązania π.
Główne cechy rozważanych typów hybrydyzacji oraz konfiguracje geometryczne cząsteczek odpowiadające niektórym typom hybrydyzacji orbitali centralnego atomu A (z uwzględnieniem wpływu niewiążących par elektronów) przedstawiono w tabeli. 4.3 i 4.4.
Tabela 4.3
Główne cechy różnych typów hybrydyzacji
Porównanie danych w tabeli. 4.2 i 4.4 możemy stwierdzić, że oba modele – OVEP i GVAO – prowadzą do tych samych wyników dotyczących struktury cząsteczek.
Tabela 4.4
Rodzaje konfiguracji przestrzennej cząsteczek odpowiadające określonym typom hybrydyzacji
Opcja 2
Część A:
1. Para pierwiastków, pomiędzy którymi tworzy się jonowe wiązanie chemiczne:
a) węgiel i siarka, b) wodór i azot, c) potas i tlen, d) krzem i wodór.
2.Wzór substancji z wiązaniem kowalencyjnym:
a) NaCl, b) HCl, c) BaO, d) Ca 3 N 2.
3.Najmniej polarne wiązanie to:
a) C – H, b) C – Cl, c) C – F, d) C – Br.
4. Stwierdzenie, że δ jest wiązaniem, w przeciwieństwie do π, jest prawdziwe:
a) słabszy, b) powstający, gdy orbitale atomowe nakładają się bocznie,
c) nie jest kowalencyjny, d) powstaje w wyniku osiowego nakładania się orbitali atomowych.
5.Substancja, w cząsteczce której nie ma wiązania π:
a) etylen, b) benzen, c) amoniak, d) azot.
6. Najsilniejszą cząsteczką jest:
a) H 2, b) N 2, c) F 2, d) O 2.
7. W jonie CO 3 2- atom węgla znajduje się w stanie hybrydowym sp 2, zatem jon ma postać:
a) liniowy, b) czworościan, c) trójkąt, d) ośmiościan.
8. Atom węgla ma stopień utlenienia -3 i wartościowość 4 w połączeniu ze wzorem:
a) CO 2, b) C 2 H 6, c) CH 3 Cl, d) CaC 2.
9. Sieć krystaliczna atomu ma:
a) soda, b) woda, c) diament, d) parafina.
10. Substancja pomiędzy cząsteczkami, w której występuje wiązanie wodorowe:
a) etan, b) fluorek sodu, c) tlenek węgla (4), d) etanol.
11. Wybierz grupę pierwiastków uszeregowanych według rosnącej elektroujemności:
a) Cl, Si, N, O, b) Si, P, N, F, c) F, Cl, O, Si, d) O, N, F, Cl.
12. Pomiędzy atomami istnieje wiązanie kowalencyjne utworzone przez mechanizm donor-akceptor w substancji, którego wzór to:
13.
14.Powstawanie wiązań wodorowych można wytłumaczyć:
a) rozpuszczalność kwasu octowego w wodzie, b) właściwości kwasowe etanolu,
c) wysoka temperatura topnienia wielu metali, d) nierozpuszczalność metanu w wodzie.
15.Wzór substancji z polarnym wiązaniem kowalencyjnym:
a) Cl 2, b) KCl, c) NH 3, d) O 2.
Część B:
B 1. Spośród zaproponowanych wybierz substancję, której cząsteczka zawiera wiązania π: H 2, CH 4, Br 2, N 2, H 2 S, CH 3 OH, NH 3. Napisz nazwę tej substancji.
B 2. Proces oddziaływania orbitali elektronowych, prowadzący do ich wyrównania pod względem kształtu i energii, nazywa się......
B 3. Jak nazywa się zjawisko powiększania się cząstek koloidalnych i ich wytrącania z roztworu koloidalnego?
B 4. Podaj przykład substancji, której cząsteczka zawiera trzy wiązania δ i jedno π. Nazwij substancję w mianowniku.
B 5. W których z poniższych substancji wiązania są najbardziej polarne: chlorowodór, fluor, woda, amoniak, siarkowodór. Zapisz wybraną substancję za pomocą wzoru.
Część C:
Od 1. Napisz wzory strukturalne wszystkich substancji izomerycznych o składzie C 4 H 8. Nazwij każdą substancję.
C 2. Utwórz wzory strukturalne substancji: CHF 3, C 2 H 2 Br 2, O 2.
Utwórz wzory graficzne: Mg 3 N 2, Na 2 SO 4, KHCO 3.
C 3.
Mg 3 N 2, Cl 2, ZnSO 4, KHS, CH 3 Cl, FeOHCl 2, BrO 2, AsO 4 3-, NH 4 +
Test nr 2 „STRUKTURA MATERII”.
Opcja 3
Część A:
1. Wiązania chemiczne w substancjach, których wzory to odpowiednio CH 4 i CaCl 2:
a) jonowo-kowalencyjny polarny, b) kowalencyjnie polarny i jonowy,
c) kowalencyjne niepolarne i jonowe, d) kowalencyjne polarne i metaliczne.
2.Polaryzacja wiązania jest większa w substancji o wzorze:
a) Br2, b) LiBr, c) HBr, d) KBr
3.Jonowy charakter wiązania w szeregu związków Li 2 O - Na 2 O - K 2 O - Rb 2 O:
a) rośnie, b) maleje, c) nie zmienia się, d) najpierw maleje, potem rośnie.
4. Pomiędzy atomami istnieje wiązanie kowalencyjne utworzone przez mechanizm donor-akceptor w substancji, którego wzór to:
a) Al(OH) 3, b) [CH 3NH 3 ]Cl, c) C 2 H 5 OH, d) C 6 H 12 O 6.
5.Kilka wzorów substancji, których cząsteczki zawierają tylko wiązania δ:
a) CH 4 i O 2, b) C 2 H 5 OH i H 2 O, c) N 2 i CO 2, d) HBr i C 2 H 4.
6. Najsilniejsze połączenie z nich:
a) C - Cl, b) C - F, c) C - Br, d) C - I.
7. Grupa wzorów związków, w których występuje podobny kierunek wiązań, ze względu na sp 3 - hybrydyzację orbitali elektronowych:
a) CH 4, C 2 H 4, C 2 H 2, b) NH 3, CH 4, H 2 O, c) H 2 O, C 2 H 6, C 6 H 6, d) C 3 H 8, BCl 3, BeCl 2.
8. Wartościowość i stopień utlenienia atomu węgla w cząsteczce metanolu są odpowiednio równe:
a) 4 i +4, b) 4 i -2, c) 3 i +2, d) 4 i -3.
9. Substancje posiadające jonową sieć krystaliczną charakteryzują się:
a) słaba rozpuszczalność w wodzie, b) wysoka temperatura wrzenia, c) topliwość, d) lotność.
10. Powstawanie wiązania wodorowego pomiędzy cząsteczkami prowadzi do:
a) w celu obniżenia temperatury wrzenia substancji, b) w celu zmniejszenia rozpuszczalności substancji w wodzie,
c) do wzrostu temperatury wrzenia substancji, d) do wzrostu lotności substancji.
11. Wzór substancji z wiązaniem jonowym:
a) NH 3, b) C 2 H 4, c) KH, d) CCl 4.
12. W cząsteczce występuje tylko wiązanie δ:
a) azot, b) etanol, c) etylen, d) tlenek węgla (4).
13. Struktura molekularna ma substancję o wzorze:
a) CH 4, b) NaOH, c) SiO 2, d) Al.
14.Wiązanie wodorowe powstaje pomiędzy:
a) cząsteczki wody, b) cząsteczki wodoru,
c) cząsteczki węglowodorów, d) atomy metali i atomy wodoru.
15.Jeśli energicznie wstrząśniesz mieszaniną oleju roślinnego i wody, otrzymasz:
a) zawiesina, b) emulsja, c) piana, d) aerozol.
Część B:
B 1. Liczba wspólnych par elektronów pomiędzy atomami bromu w cząsteczce Br2 wynosi…
B 2. Jakie wiązania tworzą wiązanie potrójne w cząsteczce N 2 (odpowiedź przedstaw w mianowniku).
B 3. W węzłach metalowej sieci krystalicznej znajdują się…….. .
B 4. Podaj przykład substancji, której cząsteczka zawiera pięć wiązań δ i dwa π. Nazwij substancję w mianowniku.
B 5. Jaka jest maksymalna liczba wiązań π, które mogą utworzyć się pomiędzy dwoma atomami w cząsteczce? (przedstaw odpowiedź jako liczbę)
Część C:
Od 1. Zapisz wzory strukturalne wszystkich substancji izomerycznych o składzie C 5 H 10 O. Nazwij każdą substancję.
C 2. Utwórz wzory strukturalne substancji: CHCl 3, C 2 H 2 Cl 2, F 2.
Utwórz formuły graficzne: AlN, CaSO 4, LiHCO 3.
C 3. Określ stopień utlenienia związków chemicznych i jonów:
HNO 3, HClO 4, K 2 SO 3, KMnO 4, CH 3 F, MgOHCl 2, ClO 3 -, CrO 4 2-, NH 4 +
Powiązana informacja.
Struktura chemiczna to sekwencja kombinacji atomów w cząsteczce i ich rozmieszczenie w przestrzeni. Strukturę chemiczną przedstawiono za pomocą wzorów strukturalnych. Kreska oznacza kowalencyjne wiązanie chemiczne. Jeśli połączenie jest wielokrotne: podwójne, potrójne, następnie wstaw dwa (nie mylić ze znakiem „równa się”) lub trzy myślniki. Jeśli to możliwe, przedstawiono kąty między wiązaniami.
Aby poprawnie skomponować wzory strukturalne substancji organicznych, należy pamiętać, że atomy węgla tworzą 4 wiązania
(tj. wartościowość węgla oparta na liczbie wiązań jest równa cztery. W chemii organicznej najczęściej stosowana jest wartościowość oparta na liczbie wiązań).
Metan(zwany także gazem bagiennym) składa się z jednego atomu węgla połączonego wiązaniami kowalencyjnymi z czterema atomami wodoru. Wzór cząsteczkowy CH4. Formuła strukturalna:
H
l
H–C–H
l
H
Kąt pomiędzy wiązaniami w cząsteczce metanu wynosi około 109° – pary elektronów tworzące kowalencyjne wiązania atomu węgla (w środku) z atomami wodoru znajdują się w przestrzeni w maksymalnej odległości od siebie.
W klasach 10–11 bada się, że cząsteczka metanu ma kształt trójkątnej piramidy - czworościanu, podobnie jak słynne egipskie piramidy.
Etylen C 2 H 4 zawiera dwa atomy węgla połączone podwójnym wiązaniem:
Kąt pomiędzy wiązaniami wynosi 120° (pary elektronów odpychają się i znajdują się w maksymalnej odległości od siebie). Atomy znajdują się w tej samej płaszczyźnie.
Jeżeli nie przedstawimy każdego atomu wodoru z osobna, otrzymamy skrócony wzór strukturalny:
Acetylen C 2 H 2 zawiera potrójne wiązanie:
H. – do. ≡ do. – godz
Kąt pomiędzy wiązaniami wynosi 180°, cząsteczka ma kształt liniowy.
Podczas spalania węglowodory tworzą tlenki węgla (IV) i wodór, czyli dwutlenek węgla i wodę, oraz wydziela się dużo ciepła:
CH 4 + 2O 2 → CO 2 + 2H 2 O
C 2H 4 + 3O 2 → 2CO 2 + 2H 2 O
2C 2 H 2 + 5O 2 → 4CO 2 + 2H 2 O (w równaniu z acetylenem przed wzorem na acetylen stawiamy współczynnik 2 tak, aby liczba atomów tlenu po prawej stronie była parzysta)
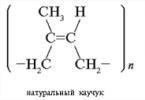
O dużym znaczeniu praktycznym reakcja polimeryzacji etylen – połączenie dużej liczby cząsteczek tworzące makrocząsteczki polimeru – polietylen. Wiązania między cząsteczkami powstają w wyniku zerwania jednego z wiązań podwójnego wiązania. Ogólnie można to zapisać tak:
nCH 2 = CH 2 → (- CH 2 – CH 2 -) n
gdzie n jest liczbą połączonych cząsteczek, zwaną stopniem polimeryzacji. Reakcja zachodzi pod podwyższonym ciśnieniem i temperaturą, w obecności katalizatora.
Folie do szklarni, osłony na puszki itp. wykonane są z polietylenu.
Tworzenie benzenu z acetylenu jest również klasyfikowane jako reakcja polimeryzacji.
Ujednolicony egzamin państwowy. Budowa materii (rodzaje wiązań chemicznych, rodzaje sieci krystalicznych, stopień utlenienia)
Rodzaje wiązań chemicznych
Lekcja poświęcona jest rozwiązywaniu zadań z egzaminu państwowego Unified State Exam na temat „Struktura materii (rodzaje wiązań chemicznych, rodzaje sieci krystalicznych, stany utlenienia).” Cele lekcji: nauczyć się porównywać rodzaje sieci krystalicznych z właściwościami materii. Na podstawie rodzaju wiązania chemicznego przewiduj rodzaje sieci krystalicznej substancji. Sprawdź, czy rozumiesz pojęcia: stopień utlenienia i wartościowość.
|
Pytanie |
Komentarz |
|
A1. Substancje złożone nazywane są: 1. związki utworzone przez różne substancje 2. związki utworzone przez różne pierwiastki chemiczne 3. związki o stałym składzie 4. związki o zmiennym składzie |
Substancja prosta to związek utworzony z atomów jednego pierwiastka chemicznego, natomiast substancja złożona składa się z atomów różnych pierwiastków chemicznych. Prawidłowa odpowiedź 2. |
|
A2. Substancją, której wzór ma najwyższą temperaturę topnienia jest: |
Trzeba wiedzieć, jakie sieci krystaliczne mają te substancje: CH 4 - molekularna, SiO 2 - atomowa, Sn - metaliczna, KF - jonowa Substancje o atomowej sieci krystalicznej charakteryzują się najwyższą temperaturą topnienia. Prawidłowa odpowiedź 2. |
|
A3. Substancjami o budowie molekularnej są wszystkie substancje z szeregu: 1. siarka, sól kuchenna, cukier 2. cukier, sól kuchenna, glicyna 3. cukier, glicyna, siarczan miedzi 4. siarka, gliceryna, cukier |
Siarka, cukier, glicyna, gliceryna to substancje o strukturze molekularnej. Sól kuchenna i siarczan miedzi mają jonową sieć krystaliczną. Są to substancje o budowie niemolekularnej. Prawidłowa odpowiedź to 4. |
|
A4. Substancje o strukturze molekularnej obejmują: 2. C 6 H 12 O 6 4. C2H5ONa |
Przeanalizujmy: do jakiego rodzaju sieci krystalicznych należą te substancje? CaO, KF, C 2 H 5 ONa mają jonową sieć krystaliczną. C 6 H 12 O 6 - molekularny. Prawidłowa odpowiedź 2. |
|
A5. Spośród wymienionych substancji struktura niemolekularna ma: |
Jeśli substancja zawiera kilka atomów (I 2), to jest substancją o budowie molekularnej. Prawidłowa odpowiedź 3. |
|
A6. Wiązanie chemiczne w bromku potasu: 1. kowalencyjny niepolarny 2. kowalencyjny polarny 3. metal |
Bromek potasu (KBr) to typowa sól utworzona przez atomy znacznie różniące się elektroujemnością. Wiązanie jest jonowe. Prawidłowa odpowiedź to 4. |
|
A7. Jakie wiązanie zachodzi pomiędzy atomami pierwiastków chemicznych o numerach seryjnych 8 i 16? 2. kowalencyjny polarny 3. kowalencyjny niepolarny 4. wodór |
Są to S i O. Są to niemetale. Ich elektroujemność jest bliska. Oznacza to, że wiązanie kowalencyjne jest polarne. Prawidłowa odpowiedź 2. |
|
A8. Wiązanie w związku utworzonym pomiędzy atomem wodoru i pierwiastkiem mającym konfigurację elektronową2 , 8 , 6 Jest: 2. kowalencyjny polarny 3. kowalencyjny niepolarny 4. metal |
Pierwiastek znajdujemy na podstawie rozkładu elektronów w atomie. Ich suma jest równa liczbie protonów, czyli liczbie atomowej. To jest nr 1 - S. Tworzą między sobą H 2 S. Obydwa są niemetalami, z niewielką różnicą w elektroujemności. Prawidłowa odpowiedź 2. |
|
A9. W kowalencyjnych związkach wodoru o składzie NE liczba wspólnych par elektronów jest równa: |
Atom wodoru ma tylko jeden elektron, więc oddziałując z innymi atomami, może utworzyć tylko jedną wspólną parę elektronów. Prawidłowa odpowiedź 1. |
|
A10. Tworzy się jedno z wiązań w jonie amonowym: 1. poprzez mechanizm dawca-akceptor 2. przyciąganie elektrostatyczne jonów azotu i wodoru 3. socjalizacja jonów azotu i wodoru 4. w wyniku wymiany elektronów |
W jonie amonowym występują 4 wiązania kowalencyjne. Trzy z nich powstają w wyniku mechanizmu wymiany, jeden w wyniku mechanizmu dawca-akceptor. Prawidłowa odpowiedź 1. |
|
A11. Stan utlenienia fosforu w związkuH 3 PO 4 jest równe: |
Suma stopni utlenienia, biorąc pod uwagę liczbę atomów, powinna być równa 0. H +, O -2, zatem P +5. Prawidłowa odpowiedź to 4. |
|
A 12. Atom pierwiastka ma stały stopień utlenienia: |
Ponieważ pierwiastki z grupy I-A mają jeden elektron walencyjny, mogą wykazywać tylko jeden stopień utlenienia +1. Prawidłowa odpowiedź to 4. |
|
A13. Sieć krystaliczna grafitu: 1. atomowy 2. molekularny 4. metal |
Grafit powstaje z węgla – niemetalu. Oznacza to, że sieć krystaliczna nie może być jonowa, metaliczna ani molekularna. Prawidłowa odpowiedź 1. |
|
A14. W węzłach sieci krystalicznych substancji o strukturze molekularnej znajdują się: 1. Cząsteczki 3. Atomy i jony 4. Cząsteczki i jony |
Cząsteczki znajdują się w węzłach sieci krystalicznych substancji o strukturze molekularnej. Prawidłowa odpowiedź 1. |
|
A15. Następujące substancje mają atomową sieć krystaliczną: 3. Naftalen |
Magnez jest metalem. Posiada metalową siatkę krystaliczną. Siarka, naftalen – molekularna sieć krystaliczna. Prawidłowa odpowiedź to 4. |
|
A16. W przypadku substancji z metalową siecią krystaliczną nietypową właściwością jest: 1. Przewodność elektryczna 2. Przewodność cieplna 3. Kruchość 4. Plastyczność |
Metale charakteryzują się następującymi właściwościami: przewodnością elektryczną i cieplną, ciągliwością, metalicznym połyskiem. Kruchość jest właściwością przeciwną plastyczności, co oznacza, że metale nie mogą jej mieć. Prawidłowa odpowiedź 3. |

Lekcja obejmowała rozwiązanie zadań z egzaminu państwowego Unified State Exam na temat „Struktura materii (rodzaje wiązań chemicznych, rodzaje sieci krystalicznych, stopnie utlenienia).” Nauczyliśmy się porównywać rodzaje sieci krystalicznych z właściwościami materii. Na podstawie rodzaju wiązania chemicznego przewiduj rodzaje sieci krystalicznej substancji. Sprawdzono zrozumienie pojęć: stopień utlenienia i wartościowość.
Bibliografia
- Rudzitis G.E. Chemia. Podstawy chemii ogólnej. Klasa 11: podręcznik dla placówek kształcenia ogólnego: poziom podstawowy / G. E. Rudzitis, F.G. Feldmana. - edycja 14. - M.: Edukacja, 2012.
- Papież P.P. Chemia: klasa 11: podręcznik dla szkół ogólnokształcących / P.P. Popel, L.S. Krivlya. - K.: IC "Akademia", 2008. - 240 s.: il.
- Materiały edukacyjno-szkoleniowe przygotowujące do jednolitego egzaminu państwowego. Chemia/Kaverina A.A., Dobrotin D.Yu., Miedwiediew Yu.N., Koroshchenko A.S. - M.: Intellect-Centrum, 2011.
- Internetrok.ru ().
- Ege.edu.ru ().
- Chemport.ru ().
- Khimik.ru ().
Praca domowa
- nr 11-33 (s. 23) Rudzitis G.E. Chemia. Podstawy chemii ogólnej. Klasa 11: podręcznik dla placówek kształcenia ogólnego: poziom podstawowy / G. E. Rudzitis, F.G. Feldmana. - edycja 14. - M.: Edukacja, 2012.
- Po całkowitym utlenieniu 2 g prostej substancji powstaje 18 g tlenku o składzie E 2 O. Znajdź masę molową prostej substancji.
- Określ wartościowość i stopień utlenienia węgla w związkach: C 2 H 5 OH, CH 3 COOH.
Badanie nr 2 DKR „STRUKTURA SUBSTANCJI”.
1. Wiązania chemiczne w substancjach, których wzory to odpowiednio CH 4 i CaCl 2:
a) jonowo-kowalencyjny polarny, b) kowalencyjnie polarny i jonowy,
c) kowalencyjne niepolarne i jonowe, d) kowalencyjne polarne i metaliczne.
2. Polaryzacja wiązania jest większa w substancji o wzorze:
a) Br2, b) LiBr, c) HBr, d) KBr
3. Jonowy charakter wiązania w szeregu związków Li 2 O - Na 2 O - K 2 O - Rb 2 O:
a) rośnie, b) maleje, c) nie zmienia się, d) najpierw maleje, potem rośnie.
4. Pomiędzy atomami istnieje wiązanie kowalencyjne utworzone przez mechanizm donor-akceptor w substancji, którego wzór to:
a) Al(OH) 3, b) [CH 3NH 3 ]Cl, c) C 2 H 5 OH, d) C 6 H 12 O 6.
5. Kilka wzorów substancji, których cząsteczki zawierają tylko wiązania δ:
a) CH 4 i O 2, b) C 2 H 5 OH i H 2 O, c) N 2 i CO 2, d) HBr i C 2 H 4.
6. Najsilniejsze połączenie z nich:
a) C - Cl, b) C - F, c) C - Br, d) C - I.
7. Grupa wzorów związków, w których występuje podobny kierunek wiązań, ze względu na sp 3 - hybrydyzację orbitali elektronowych:
a) CH 4, C 2 H 4, C 2 H 2, b) NH 3, CH 4, H 2 O, c) H 2 O, C 2 H 6, C 6 H 6, d) C 3 H 8, BCl 3, BeCl 2.
8. Wartościowość i stopień utlenienia atomu węgla w cząsteczce metanolu są odpowiednio równe:
a) 4 i +4, b) 4 i -2, c) 3 i +2, d) 4 i -3.
9. Substancje posiadające jonową sieć krystaliczną charakteryzują się:
a) słaba rozpuszczalność w wodzie, b) wysoka temperatura wrzenia, c) topliwość, d) lotność.
10. Powstawanie wiązania wodorowego pomiędzy cząsteczkami prowadzi do:
a) w celu obniżenia temperatury wrzenia substancji, b) w celu zmniejszenia rozpuszczalności substancji w wodzie,
c) do wzrostu temperatury wrzenia substancji, d) do wzrostu lotności substancji.
11. Wzór substancji z wiązaniem jonowym:
a) NH 3, b) C 2 H 4, c) KH, d) CCl 4.
12
A13. Struktura molekularna ma substancję o wzorze:
14. Wiązanie wodorowe powstaje pomiędzy:
a) cząsteczki wody, b) cząsteczki wodoru,
c) cząsteczki węglowodorów, d) atomy metali i atomy wodoru.
15. Jeśli energicznie wstrząśniesz mieszaniną oleju roślinnego i wody, otrzymasz:
a) zawiesina, b) emulsja, c) piana, d) aerozol.
16. Wzór substancji z polarnym wiązaniem kowalencyjnym:
a) Cl 2, b) KCl, c) NH 3, d) O 2.
17. Substancja pomiędzy cząsteczkami, w której występuje wiązanie wodorowe:
a) etanol, b) metan, c) wodór, d) benzen.
18. Liczba wspólnych par elektronów w cząsteczce wodoru:
a) jeden, b) dwa, c) trzy, d) cztery.
19. Polaryzacja wiązania chemicznego wzrasta w wielu związkach, których wzory są następujące:
a) NH 3, HI, O 2, b) CH 4, H 2 O, HF, c) PH 3, H 2 S, H 2, d) HCl, CH 4, CL 2.
20. Sieć krystaliczna chlorku sodu:
a) atomowy, b) jonowy, c) metaliczny, d) molekularny.
21. Liczba wiązań δ i π w cząsteczce acetylenu:
a) 5 δ i π - nie, b) 2 δ i 3 π, c) 3 δ i 2 π, d) 4 δ i 1 π.
22. Substancje o wzorach: CH 3 – CH 2 – OH i CH 3 – O – CH 3 to:
a) homologi, b) izomery, c) ta sama substancja, d) zarówno homologi, jak i izomery.
23. Homolog substancji o wzorze CH 2 = CH – CH 3 to:
a) butan, b) buten – 1, c) buten – 2, d) butyna – 1.
24. Pomiędzy atomami powstaje kowalencyjne wiązanie niepolarne:
a) wodór i tlen, b) węgiel i wodór, c) chlor, d) magnez.
25. W cząsteczce występuje tylko wiązanie δ:
a) azot, b) etanol, c) etylen, d) tlenek węgla (4).
26. Atom azotu ma wartościowość 3 i stopień utlenienia 0 w cząsteczce substancji o wzorze:
a) NH 3, b) N 2, c) CH 3 NO 2, d) N 2 O 3.
27. Struktura molekularna ma substancję o wzorze:
a) CH 4, b) NaOH, c) SiO 2, d) Al.
A28. Wiązanie C–H jest silniejsze niż wiązanie Si–H, ponieważ:
a) długość wiązania jest krótsza, b) długość wiązania jest dłuższa,
c) polaryzacja wiązania jest mniejsza, d) polaryzacja wiązania jest większa.
29. Pomiędzy atomami istnieje wiązanie kowalencyjne utworzone przez mechanizm donor-akceptor w substancji, którego wzór to:
a) CH 3 NO 2, b) NH 4 NO 2, c) C 5 H 8, d) H 2 O.
30. Najmniej polarne wiązanie to:
a) C – H, b) C – Cl, c) C – F, d) C – Br
Część B:
B 1. Liczba wspólnych par elektronów pomiędzy atomami bromu w cząsteczce Br2 wynosi…
B 2. Jakie wiązania tworzą wiązanie potrójne w cząsteczce N 2 (odpowiedź przedstaw w mianowniku).
B 3. W węzłach metalowej sieci krystalicznej znajdują się…….. .
B 4. Podaj przykład substancji, której cząsteczka zawiera pięć wiązań δ i dwa π. Nazwij substancję w mianowniku.
B 5.
B 6. Liczba wspólnych par elektronów pomiędzy atomami bromu w cząsteczce N2 wynosi…
B 7. Jakie wiązania tworzą wiązanie potrójne w cząsteczce C 2 H 2 (odpowiedź przedstaw w mianowniku).
B 8. W węzłach jonowej sieci krystalicznej znajdują się............
B 9. Podaj przykład substancji, której cząsteczka zawiera pięć wiązań δ i jedno π. Nazwij substancję w mianowniku.
B 10. Jaka jest maksymalna liczba wiązań π, które mogą utworzyć się pomiędzy dwoma atomami w cząsteczce? (przedstaw odpowiedź jako liczbę)
Część C:
Od 1. Zapisz wzory strukturalne wszystkich substancji izomerycznych o składzie C 5 H 10 O. Nazwij każdą substancję.
C 2 .
Utwórz wzory strukturalne substancji: CHCl 3, C 2 H 2 Cl 2, F 2.
Utwórz formuły graficzne: AlN, CaSO 4, LiHCO 3.
C 3.
HNO 3, HClO 4, K 2 SO 3, KMnO 4, CH 3 F, MgOHCl 2, ClO 3 -, CrO 4 2-, NH 4 +
C 4. Napisz wzory strukturalne wszystkich substancji izomerycznych o składzie C 4 H 8 O 2. Nazwij każdą substancję.
C 5 .
Utwórz wzory strukturalne substancji: CHBr 3, C 2 H 2 Br 2, Br 2.
Utwórz wzory graficzne: Al 2 S 3, MgSO 4, Li 2 CO 3.
Od 6. Określ stopień utlenienia związków chemicznych i jonów:
CCl 4, Ba(NO 3) 2, Al 2 S 3, HClO 3, Na 2 Cr 2 O 7, K 2 O 4, SrO 2-, Cr 2 O 3 2
Strona 1