Lähed pikalt väga kuuma duši alla, vannitoa peegel kattub auruga. Unustad veepoti aknale ja siis avastad, et vesi on ära keenud ja pann põlenud. Võib arvata, et veele meeldib muutuda gaasist vedelaks, seejärel vedelast gaasiks. Aga millal see juhtub?
Ventileeritavas ruumis aurustub vesi järk-järgult igal temperatuuril. Kuid see keeb ainult teatud tingimustel. Keemistemperatuur sõltub rõhust vedeliku kohal. Normaalsel atmosfäärirõhul on keemistemperatuur 100 kraadi. Kõrguse korral väheneb nii rõhk kui ka keemispunkt. Mont Blanci tipus on 85 kraadi ja seal ei saa maitsvat teed keeta! Kuid kiirkeedul on vile kõlades vee temperatuur juba 130 kraadi ja rõhk on 4 korda kõrgem atmosfäärirõhust. Sellel temperatuuril valmib toit kiiremini ja maitsed ei pääse tüübiga kaasa, sest klapp on kinni.
Aine agregatsiooni oleku muutused temperatuurimuutustega.
Iga vedelik võib muutuda gaasiliseks, kui seda piisavalt kuumutada, ja iga gaas võib muutuda vedelaks, kui seda jahutada. Seetõttu hoitakse gaasipliitides ja maal kasutatavat butaani suletud balloonides. See on vedel ja rõhu all, nagu kiirkeetja. Ja vabas õhus, temperatuuril veidi alla 0 kraadi, keeb metaan väga kiiresti ja aurustub. Veeldatud metaani hoitakse hiiglaslikes reservuaarides, mida nimetatakse tankideks. Normaalsel atmosfäärirõhul keeb metaan temperatuuril 160 miinuskraadi. Et gaas transportimisel välja ei pääseks, puudutatakse paake ettevaatlikult nagu termoseid.
Aine agregatiivsete olekute muutused koos rõhu muutumisega.
Aine vedela ja gaasilise oleku vahel on sõltuvus temperatuurist ja rõhust. Kuna vedelas olekus on aine rohkem küllastunud kui gaasilises olekus, siis võiks arvata, et rõhu tõstmisel muutub gaas koheselt vedelikuks. Aga see pole tõsi. Kui aga hakkate jalgrattapumbaga õhku kokku suruma, avastate, et see kuumeneb. See kogub energiat, mille kolvi vajutades sellele üle kannate. Gaasi saab vedelikuks kokku suruda ainult siis, kui seda samal ajal jahutada. Vastupidi, vedelikud peavad gaasiks muutumiseks saama soojust. Seetõttu võtab alkoholi või eetri aurustamine meie kehalt soojust ära, tekitades nahale külmatunde. Merevee aurustumine tuule mõjul jahutab veepinda, higistamine aga keha.
Segud võivad üksteisest erineda mitte ainult koostis, aga ka poolt välimus. Vastavalt sellele, kuidas see segu välja näeb ja millised omadused sellel on, võib selle klassifitseerida mõlemaks homogeenne (homogeenne), või selleks heterogeenne (heterogeenne) segud.
Homogeenne (homogeenne) Need on segud, milles teiste ainete osakesi ei ole võimalik tuvastada isegi mikroskoobiga.
Sellise segu kõigi osade koostis ja füüsikalised omadused on samad, kuna selle üksikute komponentide vahel pole liideseid.
TO homogeensed segud seotud:
- gaasisegud;
- lahendused;
- sulamid
Gaasi segud
Sellise homogeense segu näide on õhku.
Puhas õhk sisaldab erinevaid gaasilised ained:
- lämmastik (selle mahuosa puhtas õhus on \(78\)%));
- hapnik (\(21\)%));
- väärisgaasid - argoon ja teised (\(0,96\)%));
- süsinikdioksiid (\(0,04\)%).
Gaasiline segu on maagaas Ja seotud naftagaas. Nende segude põhikomponendid on gaasilised süsivesinikud: metaan, etaan, propaan ja butaan.
Ka gaasiline segu on taastuv ressurss nagu biogaas, mis tekib siis, kui bakterid töötlevad orgaanilisi jääke prügilates, reoveepuhastusmahutites ja spetsiaalsetes seadmetes. Biogaasi põhikomponent on metaan, mis sisaldab süsinikdioksiidi, vesiniksulfiidi ja mitmete teiste gaasiliste ainete segu.
Gaasi segud: õhk ja biogaas. Õhku saab müüa uudishimulikele turistidele ning kütusena kasutada spetsiaalsetes konteinerites rohemassist saadavat biogaasi
Lahendused
Tavaliselt nimetatakse nii vedelaid ainete segusid, kuigi sellel terminil on teaduses laiem tähendus: tavaliselt nimetatakse lahust nn. ükskõik milline(kaasa arvatud gaasilised ja tahked) homogeenne segu ained. Niisiis, vedelate lahuste kohta.
Looduses leitud oluline lahendus on õli. Selle töötlemise käigus saadud vedelad tooted: bensiin, petrooleum, diislikütus, kütteõli, määrdeõlid- on ka segu erinevatest süsivesinikud.
Pane tähele!
Lahuse valmistamiseks peate segama gaasilise, vedela või tahke aine lahustiga (vesi, alkohol, atsetoon jne).
Näiteks, ammoniaak saadakse gaasilise ammoniaagi lahustamisel sisendis. Omakorda toiduvalmistamiseks joodi tinktuurid Kristalne jood lahustatakse etüülalkoholis (etanoolis).
Vedelad homogeensed segud (lahused): õli ja ammoniaak
Sulami (tahke lahuse) saab saada põhjal mis tahes metallist ja selle koostis võib sisaldada paljusid erinevaid aineid.
Praegu on kõige olulisemad rauasulamid- malm ja teras.
Malmid on rauasulamid, mis sisaldavad rohkem kui \(2\)% süsinikku, ja terased on rauasulamid, mis sisaldavad vähem süsinikku.
See, mida tavaliselt nimetatakse "rauaks", on tegelikult madala süsinikusisaldusega teras. Välja arvatud süsinik rauasulamid võivad sisaldada räni, fosfor, väävel.
ühefaasilised süsteemid, mis koosnevad kahest või enamast komponendist. Vastavalt agregatsiooniolekule võivad lahused olla tahked, vedelad või gaasilised. Niisiis, õhk on gaasiline lahus, homogeenne gaaside segu; viina- vedel lahus, mitme aine segu, mis moodustab ühe vedela faasi; merevesi- vedel lahus, ühe vedelfaasi moodustav tahkete (sool) ja vedelate (vesi) ainete segu; messing- tahke lahus, kahe tahke aine (vask ja tsink) segu, mis moodustab ühe tahke faasi. Bensiini ja vee segu ei ole lahendus, sest need vedelikud ei lahustu üksteises, jäädes kaheks liidesega vedelfaasiks. Lahuste komponendid säilitavad oma ainulaadsed omadused ega astu üksteisega keemilistesse reaktsioonidesse uute ühendite moodustamiseks. Seega, kui segada kaks mahtu vesinikku ühe mahuosa hapnikuga, saadakse gaasiline lahus. Kui see gaasisegu süüdata, tekib uus aine- vesi, mis iseenesest ei ole lahendus. Lahuses suuremas koguses sisalduvat komponenti nimetatakse tavaliselt lahustiks, ülejäänud komponente- lahustunud ained.Mõnikord on aga raske tõmmata piiri ainete füüsikalise segunemise ja nende keemilise koostoime vahele. Näiteks gaasilise vesinikkloriidi HCl segamisel veega
H2O Moodustuvad H-ioonid 3 O+ ja Cl - . Nad meelitavad naabervee molekule enda poole, moodustades hüdraate. Seega on lähtekomponendid HCl ja H 2 O - pärast segamist läbivad olulised muutused. Sellele vaatamata käsitletakse ionisatsiooni ja hüdratatsiooni (üldjuhul solvatatsiooni) füüsikaliste protsessidena, mis toimuvad lahuste moodustumisel.Üks tähtsamaid segutüüpe, mis esindavad homogeenset faasi, on kolloidsed lahused: geelid, soolid, emulsioonid ja aerosoolid. Osakeste suurus kolloidsetes lahustes on 1-1000 nm, tõelistes lahustes
~ 0,1 nm (molekuli suuruse järgi).Põhimõisted. Kahte ainet, mis lahustuvad üksteises mis tahes vahekorras, moodustades tõelisi lahuseid, nimetatakse täielikult vastastikku lahustuvateks. Sellised ained on kõik gaasid, paljud vedelikud (näiteks etüülalkohol- vesi, glütseriin - vesi, benseen - bensiin), mõned tahked ained (näiteks hõbe - kuld). Tahkete lahuste saamiseks peate esmalt sulatama lähteained, seejärel segama need ja laskma neil tahkuda. Kui need on täielikult vastastikku lahustuvad, moodustub üks tahke faas; kui lahustuvus on osaline, jäävad ühe algkomponendi väikesed kristallid saadud tahkes aines alles.Kui kaks komponenti moodustavad ainult teatud vahekorras segamisel ühe faasi ja muudel juhtudel ilmnevad kaks faasi, nimetatakse neid osaliselt vastastikku lahustuvateks. Need on näiteks vesi ja benseen: tõelised lahused saadakse neist vaid siis, kui suurele kogusele benseenile lisatakse väike kogus vett või suurele veekogusele väike kogus benseeni. Kui segada võrdsetes kogustes vett ja benseeni, moodustub kahefaasiline vedelikusüsteem. Selle alumine kiht on vesi, milles on väike kogus benseeni, ja ülemine kiht
- benseen väikese koguse veega. Samuti on teada aineid, mis ei lahustu üksteises üldse, näiteks vesi ja elavhõbe. Kui kaks ainet lahustuvad ainult osaliselt, siis antud temperatuuril ja rõhul on piir ühe aine kogusele, mis võib tasakaalutingimustes moodustada teisega tõelise lahuse. Maksimaalse lahustunud aine kontsentratsiooniga lahust nimetatakse küllastunud. Samuti saab valmistada nn üleküllastunud lahust, milles lahustunud aine kontsentratsioon on isegi suurem kui küllastunud. Üleküllastunud lahused on aga ebastabiilsed ja vähimagi tingimuste muutumisel, näiteks segamisel, tolmuosakeste sissepääsul või lahustunud aine kristallide lisamisel, sadestub liigne lahustunud aine.Iga vedelik hakkab keema temperatuuril, mille juures selle küllastunud aururõhk jõuab välisrõhuni. Näiteks vesi rõhul 101,3 kPa keeb 100 kraadi juures
° C, sest sellel temperatuuril on veeauru rõhk täpselt 101,3 kPa. Kui lahustate vees mõne mittelenduva aine, väheneb selle aururõhk. Saadud lahuse aururõhu viimiseks 101,3 kPa-ni peate lahust kuumutama üle 100° C. Sellest järeldub, et lahuse keemistemperatuur on alati kõrgem kui puhta lahusti keemistemperatuur. Sarnaselt selgitatakse ka lahuste külmumistemperatuuri langust.Raoult' seadus. 1887. aastal kehtestas prantsuse füüsik F. Raoult, uurides mitmesuguste mittelenduvate vedelike ja tahkete ainete lahuseid, seaduse, mis seob aururõhu languse mitteelektrolüütide lahjendatud lahusel kontsentratsiooniga: aururõhu suhteline vähenemine kontsentratsiooniga. lahuse kohal olev lahusti on võrdne lahustunud aine mooliosaga. Raoult' seadus ütleb, et lahjendatud lahuse keemistemperatuuri tõus või külmumistemperatuuri langus võrreldes puhta lahustiga on võrdeline lahustunud aine molaarse kontsentratsiooniga (ehk moolifraktsiooniga) ja seda saab kasutada selle molekulmassi määramiseks.Lahendust, mille käitumine järgib Raoult' seadust, nimetatakse ideaalseks. Ideaalile kõige lähemal on mittepolaarsete gaaside ja vedelike lahused (mille molekulid elektriväljas orientatsiooni ei muuda). Sel juhul on lahustumissoojus null ja lahuste omadusi saab otseselt ennustada, teades algkomponentide omadusi ja nende segamise vahekordi. Reaalsete lahenduste puhul sellist ennustust teha ei saa. Tõeliste lahuste moodustumisel eraldub või neeldub tavaliselt soojus. Soojuse vabanemisega protsesse nimetatakse eksotermilisteks ja neeldumist endotermilisteks.
Neid lahuse omadusi, mis sõltuvad peamiselt selle kontsentratsioonist (lahustuva aine molekulide arv lahusti ruumala- või massiühikus), mitte lahustunud aine olemusest, nimetatakse nn.
kolligatiivne . Näiteks puhta vee keemistemperatuur normaalsel atmosfäärirõhul on 100° C ja lahuse keemistemperatuur, mis sisaldab 1 mooli lahustunud (mittedissotsieeruvat) ainet 1000 g vees, on juba 100,52° C olenemata selle aine olemusest. Kui aine dissotsieerub, moodustades ioone, siis keemistemperatuur tõuseb võrdeliselt lahustunud aine osakeste üldarvu suurenemisega, mis dissotsiatsiooni tõttu ületab lahusele lisatud aine molekulide arvu. Teised olulised kolligatiivsed suurused on lahuse külmumistemperatuur, osmootne rõhk ja lahustiauru osarõhk.Lahuse kontsentratsioon on suurus, mis peegeldab lahustunud aine ja lahusti vahekordi. Kvalitatiivsed mõisted nagu "lahjendatud" ja "kontsentreeritud" näitavad ainult seda, et lahus sisaldab vähe või palju lahustunud ainet. Lahuste kontsentratsiooni kvantifitseerimiseks kasutatakse sageli protsente (mass või maht) ja teaduskirjanduses - moolide või keemiliste ekvivalentide arvu. (cm . EKVIVALENTNE MASS)lahustunud aine lahusti või lahuse massi- või mahuühiku kohta. Segaduste vältimiseks tuleks kontsentratsiooniühikud alati täpselt täpsustada. Mõelge järgmisele näitele. Lahus, mis koosneb 90 g veest (selle maht on 90 ml, kuna vee tihedus on 1 g/ml) ja 10 g etüülalkoholist (maht on 12,6 ml, kuna alkoholi tihedus on 0,794 g/ml) mille mass on 100 g, kuid selle lahuse maht on 101,6 ml (ja see oleks 102,6 ml, kui vee ja alkoholi segamisel nende mahud lihtsalt liidetakse). Lahuse kontsentratsiooni protsenti saab arvutada mitmel viisil: või

Kõige tavalisem ühik on molaarsus, kuid selle arvutamisel tuleb arvesse võtta mõningaid ebaselgusi. Näiteks teatud aine 1 M lahuse saamiseks lahustatakse selle täpne kaalutud osa, mis on võrdne mol, teadaolevas väikeses koguses. mass grammides ja viia lahuse maht 1 liitrini. Selle lahuse valmistamiseks vajalik vee kogus võib sõltuvalt temperatuurist ja rõhust veidi erineda. Seetõttu ei ole kahel erinevatel tingimustel valmistatud ühemolaarsel lahusel tegelikult täpselt sama kontsentratsioon. Molaalsus arvutatakse teatud lahusti massi (1000 g) alusel, mis ei sõltu temperatuurist ja rõhust. Laboratoorses praktikas on palju mugavam mõõta teatud vedelike mahtu (selleks on olemas büretid, pipetid ja mõõtekolvid) kui neid kaaluda, seetõttu väljendatakse teaduskirjanduses kontsentratsioone sageli moolides ja molaalsus on kasutatakse tavaliselt ainult eriti täpsete mõõtmiste jaoks.
Arvutuste lihtsustamiseks kasutatakse normaalsust. Nagu me juba ütlesime, interakteeruvad ained üksteisega kogustes, mis vastavad nende ekvivalentidele. Valmistades erinevate ainete sama normaalsusega lahuseid ja võttes võrdsed mahud, saame olla kindlad, et need sisaldavad sama arvu ekvivalente.
Juhtudel, kui lahustit ja lahustunud ainet on raske (või mittevajalik) eristada, mõõdetakse kontsentratsiooni moolifraktsioonides. Moolfraktsioonid, nagu molaalsus, ei sõltu temperatuurist ja rõhust.
Teades lahustunud aine ja lahuse tihedust, saab teisendada ühe kontsentratsiooni teiseks: molaarsuse molaalsuseks, moolifraktsiooniks ja vastupidi. Antud lahustunud aine ja lahusti lahjendatud lahuste puhul on need kolm kogust üksteisega võrdelised.
Lahustuvus antud aine kohta on selle võime moodustada lahuseid teiste ainetega. Kvantitatiivselt mõõdetakse gaasi, vedeliku või tahke aine lahustuvust selle küllastunud lahuse kontsentratsiooniga antud temperatuuril. See on aine oluline omadus, mis aitab mõista selle olemust ja mõjutada reaktsioonide kulgu, milles see aine osaleb.Gaasid. Keemilise vastasmõju puudumisel segunevad gaasid omavahel mis tahes vahekorras ja sel juhul pole mõtet rääkida küllastumisest. Kui gaas lahustub vedelikus, on aga teatud piirkontsentratsioon, mis sõltub rõhust ja temperatuurist. Gaaside lahustuvus mõnes vedelikus on korrelatsioonis nende veeldamisvõimega. Kõige kergemini veeldatud gaasid, näiteks NH 3, HCl, SO 2 , lahustuvad rohkem kui raskesti veeldatavad gaasid, nagu O 2, H 2 ja Tema. Kui lahusti ja gaasi vahel on keemiline interaktsioon (näiteks vee ja NH vahel 3 või HCl) lahustuvus suureneb. Antud gaasi lahustuvus varieerub sõltuvalt lahusti olemusest, kuid gaaside järjestus vastavalt kasvavale lahustuvusele jääb erinevate lahustite puhul ligikaudu samaks.Lahustumisprotsess järgib Le Chatelier’ (1884) põhimõtet: kui tasakaalus olev süsteem on allutatud mingile mõjule, siis selles toimuvate protsesside tulemusena nihkub tasakaal sellises suunas, et mõju väheneb. Gaaside lahustumisega vedelikes kaasneb tavaliselt soojuse eraldumine. Samal ajal Le Chatelier’ põhimõtte kohaselt gaaside lahustuvus väheneb. See langus on seda märgatavam, mida suurem on gaaside lahustuvus: ka sellistel gaasidel on
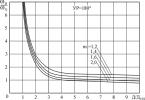
suurem lahuse kuumus. Keedetud või destilleeritud vee "pehme" maitse on seletatav õhu puudumisega selles, kuna selle lahustuvus kõrgel temperatuuril on väga madal.Rõhu tõustes suureneb gaaside lahustuvus. Henry seaduse (1803) kohaselt on gaasi mass, mis suudab lahustuda kindlas mahus vedelikus konstantsel temperatuuril, võrdeline selle rõhuga. Seda omadust kasutatakse gaseeritud jookide valmistamiseks. Süsinikdioksiid lahustatakse vedelikus rõhul 3-4 atm; nendes tingimustes võib antud mahus lahustuda 3-4 korda rohkem gaasi (massi järgi) kui rõhul 1 atm. Sellise vedelikuga anuma avamisel rõhk selles langeb ja osa lahustunud gaasist eraldub mullidena. Sarnast efekti täheldatakse ka šampanjapudeli avamisel või suurel sügavusel süsihappegaasiga küllastunud põhjavee pinnale jõudmisel.
Gaaside segu lahustamisel ühes vedelikus jääb igaühe lahustuvus samaks kui teiste komponentide puudumisel samal rõhul nagu segu puhul (Daltoni seadus).
Vedelikud. Kahe vedeliku vastastikune lahustuvus määratakse selle järgi, kui sarnane on nende molekulide struktuur ("sarnane lahustub sarnases"). Mittepolaarsetele vedelikele, näiteks süsivesinikele, on iseloomulik nõrk molekulidevaheline interaktsioon, mistõttu ühe vedeliku molekulid tungivad kergesti teise vedeliku molekulide vahele, s.t. vedelikud segunevad hästi. Seevastu polaarsed ja mittepolaarsed vedelikud, nagu vesi ja süsivesinikud, ei segune omavahel hästi. Iga veemolekul peab esmalt põgenema teiste sarnaste molekulide keskkonnast, mis teda tugevalt enda poole tõmbavad, ja tungima seda nõrgalt ligitõmbavate süsivesinike molekulide vahele. Ja vastupidi, süsivesiniku molekulid peavad vees lahustumiseks pigistama veemolekulide vahele, ületades nende tugeva vastastikuse külgetõmbe ja see nõuab energiat. Temperatuuri tõustes suureneb molekulide kineetiline energia, nõrgenevad molekulidevahelised vastasmõjud ning suureneb vee ja süsivesinike lahustuvus. Temperatuuri olulise tõusuga on võimalik saavutada nende täielik vastastikune lahustuvus. Seda temperatuuri nimetatakse ülemiseks kriitiliseks lahuse temperatuuriks (UCST).Mõnel juhul suureneb kahe osaliselt seguneva vedeliku vastastikune lahustuvus temperatuuri langedes. See efekt ilmneb siis, kui segamisel tekib soojus, tavaliselt keemilise reaktsiooni tulemusena. Temperatuuri olulise langusega, kuid mitte alla külmumispunkti, on võimalik saavutada madalam kriitiline lahuse temperatuur (LCST). Võib eeldada, et kõikidel LCTE-ga süsteemidel on ka HCTE (vastupidine pole vajalik). Kuid enamikul juhtudel keeb üks segamisvedelik HTST-st madalamal temperatuuril. Nikotiini-vee süsteemi LCTR on 61
° C ja VCTR on 208° C. Vahemikus 61-208° C, nende vedelike lahustuvus on piiratud ja väljaspool seda vahemikku on neil täielik vastastikune lahustuvus.Tahked ained. Kõigi tahkete ainete lahustuvus vedelikes on piiratud. Nende küllastunud lahused antud temperatuuril on kindla koostisega, mis sõltub lahustunud aine ja lahusti olemusest. Seega on naatriumkloriidi lahustuvus vees mitu miljonit korda kõrgem kui naftaleeni lahustuvus vees ja kui need lahustada benseenis, siis tekib vastupidine pilt. See näide illustreerib üldreeglit, et tahke aine lahustub kergesti sarnaste keemiliste ja füüsikaliste omadustega vedelikus, kuid ei lahustu vastupidiste omadustega vedelikus.Soolad lahustuvad tavaliselt kergesti vees ja vähem teistes polaarsetes lahustites, nagu alkohol ja vedel ammoniaak. Samas varieerub oluliselt ka soolade lahustuvus: näiteks ammooniumnitraat lahustub vees miljoneid kordi paremini kui hõbekloriid.
Tahkete ainete lahustumisega vedelikes kaasneb tavaliselt soojuse neeldumine ja Le Chatelier’ põhimõtte järgi peaks nende lahustuvus kuumutamisel suurenema. Seda efekti saab kasutada ainete puhastamiseks ümberkristallimise teel. Selleks lahustatakse need kõrgel temperatuuril kuni küllastunud lahuse saamiseni, seejärel lahus jahutatakse ja pärast lahustunud aine sadestumist filtreeritakse. On aineid (näiteks kaltsiumhüdroksiid, sulfaat ja atsetaat), mille lahustuvus vees temperatuuri tõustes väheneb.
Tahked ained, nagu vedelikud, võivad samuti üksteises täielikult lahustuda, moodustades homogeense segu – tõelise tahke lahuse, mis sarnaneb vedela lahusega. Üksteises osaliselt lahustuvad ained moodustavad kaks tasakaalulist konjugeeritud tahket lahust, mille koostis muutub koos temperatuuriga.
Jaotuskoefitsient. Kui kahest mittesegunevast või osaliselt segunevast vedelikust koosnevasse tasakaalusüsteemi lisatakse mingi aine lahus, jaotub see vedelike vahel kindlas vahekorras, sõltumata aine üldkogusest, keemiliste vastasmõjude puudumisel süsteemis. . Seda reeglit nimetatakse jaotusseaduseks ja vedelikes lahustunud aine kontsentratsioonide suhet jaotuskoefitsiendiks. Jaotuskoefitsient on ligikaudu võrdne antud aine lahustuvuste suhtega kahes vedelikus, s.o. aine jaotub vedelike vahel vastavalt lahustuvusele. Seda omadust kasutatakse antud aine ekstraheerimiseks selle lahusest ühes lahustis, kasutades teist lahustit. Teine näide selle kasutamisest on hõbeda kaevandamise protsess maakidest, millesse see sageli kaasatakse koos pliiga. Selleks lisatakse sulamaagile tsinki, mis ei segune pliiga. Hõbe jaotub sula plii ja tsingi vahel, peamiselt viimase ülemises kihis. See kiht kogutakse ja hõbe eraldatakse tsingi destilleerimisega.Lahustuvusprodukt (JNE ). Liigse (sademe) tahke aine vahel M x B y ja selle küllastunud lahus loob võrrandiga kirjeldatud dünaamilise tasakaaluSelle reaktsiooni tasakaalukonstant onRemy I. Anorgaanilise keemia kursus , vol. 1-2. M., 1963, 1966
Tänapäeval on teada enam kui 3 miljoni erineva aine olemasolu. Ja see arv kasvab iga aastaga, kuna sünteetilised keemikud ja teised teadlased teevad pidevalt katseid, et saada uusi ühendeid, millel on mõned kasulikud omadused.
Mõned ained on looduslikud elanikud, moodustunud looduslikult. Teised pooled on kunstlikud ja sünteetilised. Kuid nii esimesel kui ka teisel juhul moodustavad olulise osa gaasilised ained, mille näiteid ja omadusi käsitleme selles artiklis.
Ainete koondseisundid
Alates 17. sajandist on üldiselt aktsepteeritud, et kõik teadaolevad ühendid on võimelised eksisteerima kolmes agregatsiooni olekus: tahked, vedelad ja gaasilised ained. Viimaste aastakümnete hoolikad uuringud astronoomia, füüsika, keemia, kosmosebioloogia ja teiste teaduste vallas on aga tõestanud, et on olemas ka teine vorm. See on plasma.
Mis ta on? See on osaliselt või täielikult ja selgub, et selliseid aineid on universumis valdav enamus. Seega leitakse plasma olekus järgmine:
- tähtedevaheline aine;
- kosmiline aine;
- atmosfääri ülemised kihid;
- udukogud;
- paljude planeetide koostis;
- tähed.
Seetõttu öeldakse tänapäeval, et on olemas tahked ained, vedelikud, gaasid ja plasma. Muide, iga gaasi saab kunstlikult sellesse olekusse üle viia, kui see allutatakse ioniseerimisele, st sunnitakse muutuma ioonideks.
Gaasilised ained: näited
Vaadeldavate ainete näiteid on palju. On ju gaase tuntud juba 17. sajandist, mil loodusteadlane van Helmont esmakordselt süsihappegaasi hankis ja selle omadusi uurima hakkas. Muide, ta andis sellele ühendite rühmale ka nime, kuna tema arvates on gaasid midagi korratut, kaootilist, vaimudega seotud ja midagi nähtamatut, kuid käegakatsutavat. See nimi on juurdunud Venemaal.
Kõik gaasilised ained on võimalik klassifitseerida, siis on lihtsam näiteid tuua. Kogu mitmekesisust on ju raske katta.
Kompositsiooni järgi eristatakse neid:
- lihtne,
- komplekssed molekulid.
Esimesse rühma kuuluvad need, mis koosnevad mis tahes koguses identsetest aatomitest. Näide: hapnik - O 2, osoon - O 3, vesinik - H 2, kloor - CL 2, fluor - F 2, lämmastik - N 2 ja teised.
- vesiniksulfiid - H2S;
- vesinikkloriid - HCL;
- metaan - CH4;
- vääveldioksiid - SO 2;
- pruun gaas - NO 2;
- freoon - CF 2 CL 2;
- ammoniaak - NH 3 ja teised.

Ainete liigitus olemuse järgi
Samuti on võimalik klassifitseerida gaasiliste ainete tüüpe nende kuuluvuse järgi orgaanilisse ja anorgaanilisse maailma. See tähendab seda moodustavate aatomite olemuse järgi. Orgaanilised gaasid on:
- esimesed viis esindajat (metaan, etaan, propaan, butaan, pentaan). Üldvalem C n H 2n+2 ;
- etüleen - C2H4;
- atsetüleen või etüleen - C 2 H 2;
- metüülamiin - CH 3 NH 2 ja teised.
Teine klassifikatsioon, mida saab kõnealuste ühendite puhul rakendada, on jagamine nendes sisalduvate osakeste alusel. Kõik gaasilised ained ei koosne aatomitest. Struktuuride näited, milles esinevad ioonid, molekulid, footonid, elektronid, Browni osakesed ja plasma, viitavad samuti sellises agregatsiooniseisundis olevatele ühenditele.
Gaaside omadused
Vaadeldavas olekus ainete omadused erinevad tahkete või vedelate ühendite omadustest. Asi on selles, et gaasiliste ainete omadused on erilised. Nende osakesed on kergesti ja kiiresti liikuvad, aine tervikuna on isotroopne, see tähendab, et omadusi ei määra koostises sisalduvate struktuuride liikumissuund.
On võimalik kindlaks teha gaasiliste ainete kõige olulisemad füüsikalised omadused, mis eristavad neid kõigist muudest aine eksisteerimisvormidest.
- Need on seosed, mida tavaliste inimeste vahenditega ei saa näha, kontrollida ega tunda. Omaduste mõistmiseks ja konkreetse gaasi tuvastamiseks tuginevad nad neljale parameetrile, mis neid kõiki kirjeldavad: rõhk, temperatuur, aine kogus (mol), maht.
- Erinevalt vedelikest on gaasid võimelised hõivama kogu ruumi ilma jälgi, mida piirab ainult anuma või ruumi suurus.
- Kõik gaasid segunevad üksteisega kergesti ja neil ühenditel puudub liides.
- On kergemaid ja raskemaid esindajaid, nii et gravitatsiooni ja aja mõjul on võimalik näha nende eraldumist.
- Difusioon on nende ühendite üks olulisemaid omadusi. Võime tungida teistesse ainetesse ja neid seestpoolt küllastada, tehes samal ajal oma struktuuris täiesti korratuid liigutusi.
- Päris gaasid ei suuda elektrivoolu juhtida, kuid kui rääkida haruldastest ja ioniseeritud ainetest, siis juhtivus suureneb järsult.
- Gaaside soojusmahtuvus ja soojusjuhtivus on madal ning eri liikide lõikes erinev.
- Viskoossus suureneb rõhu ja temperatuuri tõustes.
- Faasidevaheliseks üleminekuks on kaks võimalust: aurustamine - vedelik muutub auruks, sublimatsioon - tahke aine, möödudes vedelast, muutub gaasiliseks.
Tõeliste gaaside aurude eripäraks on see, et esimesed on teatud tingimustel võimelised muutuma vedelaks või tahkeks faasiks, teised aga mitte. Samuti tuleb märkida, et kõnealused ühendid on võimelised vastu pidama deformatsioonile ja olema vedelad.

Sellised gaasiliste ainete omadused võimaldavad neid laialdaselt kasutada erinevates teaduse ja tehnoloogia valdkondades, tööstuses ja rahvamajanduses. Lisaks on konkreetsed omadused iga esindaja jaoks rangelt individuaalsed. Võtsime arvesse ainult kõigi reaalsete struktuuride ühiseid tunnuseid.
Kokkusurutavus
Erinevatel temperatuuridel ja ka rõhu mõjul on gaasid võimelised kokku suruma, suurendades nende kontsentratsiooni ja vähendades nende hõivatud mahtu. Kõrgendatud temperatuuril nad paisuvad, madalal tõmbuvad kokku.
Muutused toimuvad ka surve all. Gaasiliste ainete tihedus suureneb ja kriitilise punkti saavutamisel, mis on igal esindajal erinev, võib toimuda üleminek teise agregatsiooniseisundisse.

Peamised teadlased, kes aitasid kaasa gaaside uurimise arendamisele
Selliseid inimesi on palju, sest gaaside uurimine on töömahukas ja ajalooliselt pikk protsess. Vaatleme kõige kuulsamatel isiksustel, kellel õnnestus teha kõige olulisemad avastused.
- tegi avastuse 1811. aastal. Pole tähtis, millised gaasid on, peaasi, et samadel tingimustel oleks ühes mahus neid molekulide arvu poolest võrdne kogus. Teadlase nime järgi on nimetatud arvutuslik väärtus. See võrdub 6,03 * 10 23 molekuliga 1 mooli mis tahes gaasi kohta.
- Fermi – lõi ideaalse kvantgaasi teooria.
- Gay-Lussac, Boyle-Marriott - nende teadlaste nimed, kes koostasid arvutuste jaoks põhilised kineetilised võrrandid.
- Robert Boyle.
- John Dalton.
- Jacques Charles ja paljud teised teadlased.
Gaasiliste ainete struktuur
Vaadeldavate ainete kristallvõre ehitamisel on kõige olulisem see, et selle sõlmedes on kas aatomeid või molekule, mis on omavahel ühendatud nõrkade kovalentsete sidemetega. Van der Waalsi jõud on olemas ka ioonide, elektronide ja muude kvantsüsteemide puhul.
Seetõttu on gaasivõrede peamised struktuuritüübid:
- aatomi;
- molekulaarne.
Sees olevad ühendused on kergesti purunevad, mistõttu need ühendused ei ole püsiva kujuga, vaid täidavad kogu ruumilise mahu. See seletab ka elektrijuhtivuse puudumist ja halba soojusjuhtivust. Kuid gaasidel on hea soojusisolatsioon, kuna tänu difusioonile suudavad nad tungida tahketesse ainetesse ja hõivata nende sees vabu klastriruume. Samal ajal ei lase õhku läbi, soojus säilib. See on aluseks gaaside ja tahkete ainete kombineeritud kasutamisele ehituseesmärkidel.

Lihtsad ained gaaside hulgas
Oleme juba eespool arutanud, millised gaasid kuuluvad sellesse kategooriasse oma struktuuri ja struktuuri poolest. Need on need, mis koosnevad identsetest aatomitest. Näiteid võib tuua palju, sest oluline osa mittemetallidest kogu perioodilisest tabelist tavatingimustes eksisteerib just sellises agregatsiooniseisundis. Näiteks:
- valge fosfor - üks sellest elemendist;
- lämmastik;
- hapnik;
- fluor;
- kloor;
- heelium;
- neoon;
- argoon;
- krüptoon;
- ksenoon.
Nende gaaside molekulid võivad olla kas üheaatomilised (väärisgaasid) või mitmeaatomilised (osoon - O 3). Sideme tüüp on kovalentne mittepolaarne, enamikul juhtudel on see üsna nõrk, kuid mitte kõigil. Kristallvõre on molekulaarset tüüpi, mis võimaldab neil ainetel kergesti liikuda ühest agregatsiooniseisundist teise. Näiteks jood on tavatingimustes tumelillad metallilise läikega kristallid. Kuumutamisel sublimeeruvad nad aga helelilla gaasipilvedeks - I 2.

Muide, mis tahes aine, sealhulgas metallid, võib teatud tingimustel eksisteerida gaasilises olekus.
Gaasilise olemusega komplekssed ühendid
Selliseid gaase on muidugi enamus. Erinevad aatomite kombinatsioonid molekulides, mida ühendavad kovalentsed sidemed ja van der Waalsi interaktsioonid, võimaldavad moodustada sadu erinevaid vaadeldava agregatsiooniseisundi esindajaid.
Keeruliste ainete näideteks gaaside hulgas võivad olla kõik ühendid, mis koosnevad kahest või enamast erinevast elemendist. See võib hõlmata järgmist:
- propaan;
- butaan;
- atsetüleen;
- ammoniaak;
- silaan;
- fosfiin;
- metaan;
- süsinikdisulfiid;
- vääveldioksiid;
- pruun gaas;
- freoon;
- etüleen ja teised.
Molekulaarset tüüpi kristallvõre. Paljud esindajad lahustuvad vees kergesti, moodustades vastavad happed. Enamik neist ühenditest on tööstuses läbiviidava keemilise sünteesi oluline osa.
Metaan ja selle homoloogid
Mõnikord viitab "gaas" üldmõiste looduslikule mineraalile, mis on valdavalt orgaanilise olemusega gaasiliste saaduste segu. See sisaldab selliseid aineid nagu:
- metaan;
- etaan;
- propaan;
- butaan;
- etüleen;
- atsetüleen;
- pentaan ja mõned teised.
Tööstuses on need väga olulised, sest propaani-butaani segu on majapidamisgaas, millega inimesed süüa teevad, mida kasutatakse energia- ja soojusallikana.

Paljusid neist kasutatakse alkoholide, aldehüüdide, hapete ja muude orgaaniliste ainete sünteesiks. Maagaasi aastane tarbimine ulatub triljonitesse kuupmeetritesse ja see on igati õigustatud.
Hapnik ja süsinikdioksiid
Milliseid gaasilisi aineid võib nimetada kõige levinumaks ja isegi esimese klassi õpilastele teadaolevateks? Vastus on ilmne – hapnik ja süsihappegaas. Lõppude lõpuks on nad otsesed osalejad gaasivahetuses, mis toimub kõigis planeedi elusolendites.
On teada, et elu on võimalik tänu hapnikule, kuna ilma selleta saavad eksisteerida ainult teatud tüüpi anaeroobsed bakterid. Ja süsihappegaas on vajalik "toiduaine" kõikidele taimedele, mis seda neelavad, et viia läbi fotosünteesi.
Keemilisest vaatenurgast on nii hapnik kui ka süsihappegaas ühendite sünteesi läbiviimiseks olulised ained. Esimene on tugev oksüdeeriv aine, teine on sagedamini redutseerija.
Halogeenid
See on ühendite rühm, milles aatomid on gaasilise aine osakesed, mis on omavahel paarikaupa ühendatud kovalentse mittepolaarse sideme kaudu. Kuid mitte kõik halogeenid ei ole gaasid. Broom on tavatingimustes vedelik ja jood kergesti sublimeeruv tahke aine. Fluor ja kloor on elusolendite tervisele ohtlikud mürgised ained, mis on tugevad oksüdeerijad ja mida kasutatakse sünteesides väga laialdaselt.
Harjutus 1. Sisesta need omadussõnad punktide asemel vedel, tahke, gaasiline .
Harjutus 2. Vasta küsimustele.
1. Milliseid aineid leidub looduses?
2. Millises olekus on sool?
3. Millises olekus on broom?
4. Millises olekus on lämmastik?
5. Millises olekus on vesinik ja hapnik?
Harjutus 3. Sisesta punktide asemel vajalikud sõnad.
1. Looduses on... aineid.
2. Broom on ... olekus.
3. Sool on... aine.
4. Lämmastik on ... olekus.
5. Vesinik ja hapnik on... ained.
6. Nad on... seisukorras.
Harjutus 4. Kuulake teksti. Lugege seda valjusti.
Keemilised ained on vees lahustuvad või lahustumatud. Näiteks väävel (S) on vees lahustumatu. Jood (I 2) ei lahustu ka vees. Hapnik (O 2) ja lämmastik (N 2) lahustuvad vees halvasti. Need on vees vähelahustuvad ained. Mõned kemikaalid lahustuvad vees hästi, näiteks suhkur.
Harjutus 5. Vasta 4. ülesande teksti küsimustele. Kirjuta vastused vihikusse.
1. Millised ained ei lahustu vees?
2. Millised ained lahustuvad vees hästi?
3. Milliseid vees vähelahustuvaid aineid teate?
Harjutus 6. Lõpeta laused.
1. Kemikaalid lahustuvad või….
2. Mõned kemikaalid on head...
3. Glükoos ja sahharoos...
4. Hapnik ja lämmastik on halvad...
5. Väävel ja jood….
Harjutus 7. Kirjutage lauseid. Kasutage sulgudes olevaid sõnu õiges vormis.
1. Sool lahustub (tavalises vees).
2. Mõned rasvad lahustuvad (bensiin).
3. Hõbe lahustub (lämmastikhappes).
4. Paljud metallid lahustuvad (väävelhape - H 2 SO 4).
5. Klaas ei lahustu isegi (vesinikkloriidhape - HCl).
6. Hapnik ja lämmastik lahustuvad (vees) halvasti.
7. Jood lahustub hästi (alkoholis või benseenis).
Harjutus 8. Kuulake teksti. Lugege see ette.
Kõigil ainetel on füüsikalised omadused. Füüsikalised omadused on värvus, maitse ja lõhn. Näiteks suhkur on valget värvi ja maitseb magusalt. Kloor (Cl 2) on kollakasrohelise värvusega ja tugeva ebameeldiva lõhnaga. Väävel (S) on kollase värvusega ja broom (Br 2) on tumepunane. Grafiit (C) on tumehalli värvi ja vask (Cu) heleroosa. NaCl sool on valge värvusega ja soolase maitsega. Mõned soolad on mõru maitsega. Broomil on terav lõhn.
Ülesanne 9. Vasta 8. ülesande teksti küsimustele. Kirjuta vastused vihikusse.
1. Milliseid füüsikalisi omadusi sa tead?
2. Millised füüsikalised omadused on suhkrul?
3. Millised füüsikalised omadused on klooril?
4. Mis värvi on grafiit, väävel, broom ja vask?
5. Millised füüsikalised omadused on naatriumkloriidil (NaCl)?
6. Kuidas mõned soolad maitsevad?
7. Kuidas broom lõhnab?
Harjutus 10. Moodusta mudeli põhjal lauseid.
Näidis: Lämmastik on maitse. Lämmastikus ei ole maitset. Lämmastikus pole maitset. Lämmastik on maitseta aine.
1. Naatriumkloriid - lõhn. -...
2. Kriit – maitse ja lõhn. -...
3. Alkohol on värv. -...
4. Vesi – maitse, värv ja lõhn. -...
5. Suhkur on lõhn. -...
6. Grafiit – maitse ja lõhn. –….
Harjutus 11. Ütle, et ainetel on samad omadused kui veel.
Näidis: Vesi on kompleksaine, etüülalkohol on samuti kompleksaine.
1. Vesi on vedelik, lämmastikhape ka...
2. Vesi on läbipaistev aine, väävelhape ka...
3. Vesi pole värvi, teemandil ka mitte...
4. Vesi ei lõhna, hapnik ka... .
Harjutus 12. Ütle, et veel on erinevad omadused kui etüülalkoholil.
1. Etüülalkohol on kerge vedelik ja vesi...
2. Etüülalkoholil on iseloomulik lõhn ja vesi...
3. Etüülalkoholil on madal keemispunkt ja vesi....
Harjutus 13. Täpsustage järgmisi sõnumeid, kasutage sõnu iseloomulik, spetsiifiline, terav, violetne, punakaspruun, värvitu, kõrge, kollane .
Näidis: Broom on tume vedelik. Broom on tumepunane vedelik.
1. Etüülalkoholil on lõhn. 2. Joodil on lõhn. 3. Joodiaur on värviline. 4. Tume joodilahus. 5. Väävelhape on vedelik. 6. Väävelhappel on keemistemperatuur. 7. Väävel on värvi.
Harjutus 14. Rääkige ainete füüsikalistest omadustest, kasutage etteantud sõnu ja väljendeid.
1. Fluor (F 2) – gaas – heleroheline värvus – terav lõhn – mürgine.
2. Kloor (Cl 2) – gaas – kollakasroheline värvus – terav lõhn – mürgine.