Aineiden ominaisuuksien riippuvuus niistä
rakennukset. Kemiallinen sidos. Perus
kemiallisten sidosten tyypit.
Käsitellyt ongelmat:
1. Aineen järjestäytymistasot. Rakenteen hierarkia.
2. Molekyyli- ja ei-molekyylirakenteiset aineet.
3.
4. Kemiallisten sidosten syntymisen syyt.
5. Kovalenttinen sidos: muodostumismekanismit, menetelmät
atomiradan limitys, polariteetti, dipolimomentti
molekyylejä.
6. Ionisidos.
7. Polaaristen kovalenttisten ja ionisten sidosten vertailu.
8. Kovalenttisten polaaristen aineiden ominaisuuksien vertailu
ionisidokset.
9. Metalliliitos.
10. Molekyylien väliset vuorovaikutukset. Aine (yli 70 miljoonaa)
Mitä sinun tulee tietää kustakin aineesta?
Kaava (mistä se koostuu)
Rakenne (miten se toimii)
Fyysiset ominaisuudet
Kemialliset ominaisuudet
Hankintamenetelmät
(laboratorio ja teollisuus)
6. Käytännön sovellus
1.
2.
3.
4.
5.Aineen rakenteen hierarkia
Kaikki aineet
koostua
atomeja, mutta ei
kaikki on peräisin
molekyylejä.
Atomi
Molekyyli
Kaikille aineille
Vain aineille
molekyylinen
rakennukset
Nano taso
Kaikille aineille
Volumetrinen (makro)
taso
Kaikille aineille
Kaikki 4 tasoa ovat kemian opiskelun kohteena Molekyyliset aineet
ja ei-molekyylirakenne Aineet
Molekyyli
rakennukset
Ei-molekyyli
rakennukset
Koostuu molekyyleistä
Koostuu atomeista
tai ioneja
H2O, CO2, HNO3, C60,
lähes kaikki org. aineet
Timantti, grafiitti, SiO2,
metallit, suolat
Kaava heijastaa
molekyylikoostumus
Kaava heijastaa koostumusta
kaavan yksikkö Aineet
Natriumkloridia
Kaavan yksikkö NaCl Aineet
Piidioksidi
Kaavan yksikkö SiO2
Fersman-mineraloginen museo sijaitsee lähellä Neskuchny-puutarhan sisäänkäyntiä.
Osoite: Moskova, Leninski Prospekt, rakennus 18, rakennus 2. Erilaisia kemiallisia rakenteita.
ponneaine
C5H6
Coronen
(superbentseeni)
C24H12
cavitand
C36H32O8 Erilaisia kemiallisia rakenteita.
catenane Erilaisia kemiallisia rakenteita.
catenane Erilaisia kemiallisia rakenteita.
Mobius-nauha Molekyyli
Molekyyli on vakaa järjestelmä, joka koostuu useista
atomiytimiä ja elektroneja.
Atomit yhdistyvät molekyyleiksi muodostamalla
kemialliset sidokset.
Pääasiallinen liikkeellepaneva voima molekyylin muodostumiselle
atomit – kokonaisenergian väheneminen.
Molekyyleillä on geometrinen muoto, joka on tunnusomaista
ytimien väliset etäisyydet ja sidosten väliset kulmat. Tärkein liikkeellepaneva voima
kemiallisen sidoksen muodostuminen
aineen hiukkasten välillä -
kokonaisenergian väheneminen
järjestelmät. Kemikaalien päätyypit
liitännät:
1. Ioninen
2. Kovalenttinen
3. Metalli
Perusmolekyylien välinen
vuorovaikutus:
1. Vetysidokset
2. Van der Waalsin liitännät Ionisidos
Jos sidoksen muodostavat jyrkästi erilaiset atomit
elektronegatiivisuusarvot (ΔOOE ≥ 1,7),
jaettu elektronipari lähes kokonaan
siirtyy elektronegatiivisempaan suuntaan
atomi.
Na Cl
OEO 0,9 3,16
∆ 2,26
+Na
Anion
: Clcation
Ionien välillä muodostuva kemiallinen sidos
niiden sähköstaattisen vetovoiman vuoksi,
kutsutaan ioniseksi. Ionisidos
Coulombin potentiaali on pallomainen
symmetrinen, kaikkiin suuntiin suunnattu,
siksi ionisidos on suuntaamaton.
Coulombin potentiaalia ei ole
määrällisiä rajoituksia
lisätyt vastaionit -
tästä syystä ionisidos
kyltymätön. Ionisidos
Yhdisteet, joissa on ionisidostyyppiä
kiinteä, hyvin liukeneva
polaarisia liuottimia, on korkea
sulamis- ja kiehumispisteet. Ionisidos
Käyrä I: ionin vetovoima, jos
edustavatko he
pistemaksut.
Käyrä II: ytimien hylkiminen sisään
jos ionit ovat lähellä.
Käyrä III: minimienergia E0 at
vastaa käyrää
ionien tasapainotila
parit, joissa voimat
elektronien vetovoima ytimiin
kompensoidaan voimilla
ytimien torjuminen keskenään
etäisyys r0, Kemiallinen sidos molekyyleissä
Kemiallisia sidoksia molekyyleissä voidaan kuvata
kahden menetelmän asemat:
- valenssisidosmenetelmä, MBC
- molekyylikiertomenetelmä, MMO Valenssisidosmenetelmä
Heitler-London teoria
BC-menetelmän perussäännökset:
1. Sidos muodostuu kahdesta vastakkaisesta elektronista
pyörii ja aallon aallot menevät päällekkäin
funktiot ja niiden välinen elektronitiheys
ytimet.
2. Kytkentä on lokalisoitu maksimisuuntaan
limittyvät elektronien Ψ-funktiot. Mitä vahvempi
päällekkäin, sitä vahvempi sidos.
dsv - pituus
viestintä;
ESV - energia
viestintää. Vetymolekyylin muodostuminen:
N· + ·N → N:N
Kun kaksi atomia yhdistyy
houkuttelevia voimia syntyy ja
vastenmielisyys:
1) vetovoima: "elektroni-ydin"
viereiset atomit;
2) karkotukset: "ytimestä ytimeen",
"elektroni-elektroni" naapuri
atomeja. Vetymolekyylin muodostuminen:
Molekyyli
kahden elektronin pilvi,
joilla on maksimi
elektronitiheys. Kemiallinen sidos suoritetaan yhteisellä
elektroniparia kutsutaan kovalenttiseksi.
Jaettu elektronipari voidaan muodostaa kahdella
tapoja:
1) kahden parittoman elektronin yhdistymisen seurauksena:
2) jakamattomien sosialisoitumisen seurauksena
yhden atomin elektronipari (luovuttaja) ja tyhjä
toisen (akseptorin) kiertoradat.
Kaksi mekanismia kovalenttisten sidosten muodostumiseen:
vaihto ja luovuttaja-vastaanotin.
viestintätiheys esiintyy linjaa pitkin,
yhdistävät atomien (ytimien) keskustat, niin tämä
päällekkäisyyttä kutsutaan σ-kytkennällä: Menetelmät atomiorbitaalien päällekkäin
kovalenttisen sidoksen muodostumista
Jos muodostuminen suurin sähköinen
sidostiheys esiintyy molemmilla puolilla
linja, joka yhdistää atomien (ytimien) keskustat
tällaista päällekkäisyyttä kutsutaan π-sidokseksi: Polaarinen ja ei-polaarinen kovalenttinen sidos
1) Jos sidos muodostuu identtisistä atomeista,
kahden elektronin viestintäpilvi jaettu sisään
tilaa symmetrisesti niiden ytimien välillä - sellainen
sidosta kutsutaan ei-polaariseksi: H2, Cl2, N2.
2) jos sidos muodostuu eri atomeista, sidospilvi
siirtynyt elektronegatiivisempaan atomiin
- tällaista sidosta kutsutaan polaariseksi: HCl, NH3, CO2. Polaarinen kovalenttinen sidos
Kytkennän dipolimomentti
Dipoli
H+8Cl-8 tai H+0,18Cl-0,18
Missä ±δ on tehokas
atomivaraus, murto-osa
absoluuttinen maksu
elektroni.
+δ
-δ
Ei pidä sekoittaa hapetustilaan!
l
Tehollisen varauksen ja dipolipituuden tulo
kutsutaan dipolin sähkömomentiksi: μ = δl
Tämä on vektorisuure: suunnattu positiivisesta
lataus negatiiviseksi. Polaarinen kovalenttinen sidos
Molekyylin dipolimomentti
Molekyylin dipolimomentti on yhtä suuri kuin summa
sidosten dipolimomenttien vektorit, ottaen huomioon
yksinäisiä elektronipareja.
Dipolimomentin yksikkö
on Debye: 1D = 3,3·10-30 C·m. Polaarinen kovalenttinen sidos
Molekyylin dipolimomentti
Tulossa μ = δl molemmat suureet ovat vastakkaisia.
Siksi syytä on seurattava huolellisesti
muutoksia μ.
Esimerkiksi,
CsF
CsCl
24
31
δ "kadonnut" l
CsI
HF
HCl
HBr
HEI
37
5,73
3,24
2,97
1,14
päinvastoin Polaarinen kovalenttinen sidos
Molekyylin dipolimomentti
Voiko molekyyli olla ei-polaarinen, jos
Ovatko kaikki sen liitännät napaisia?
AB-tyypin molekyylit ovat aina polaarisia.
AB2-tyypin molekyylit voivat olla sekä polaarisia että polaarisia
ei-polaarinen...
H2O
NOIN
N
CO2
μ>0
N
NOIN
KANSSA
μ=0
NOIN Polaarinen kovalenttinen sidos
Molekyylit, jotka koostuvat kolmesta tai useammasta atomista
(AB2, AB3, AB4, AB5, AB6) ,
voivat olla ei-polaarisia, jos ne ovat symmetrisiä.
Mihin dipolimomentin läsnäolo vaikuttaa?
molekyylejä?
On olemassa molekyylien välisiä vuorovaikutuksia ja
Tämän seurauksena aineen tiheys kasvaa,
sulamislämpötila ja kiehumislämpötila. Ioni- ja kovalenttisten polaaristen sidosten vertailu
Yleinen: yleinen koulutus
elektronipari.
Ero: tutkinto
yleinen siirtymä
elektronipari
(sidoksen polarisaatio).
Ionisidosta tulisi pitää äärimmäisenä
polaarisen kovalenttisen sidoksen tapaus.
polaariset sidokset
Kovalenttinen sidos: kyllästynyt ja suunnattu
Kylläisyys (maksimi valenssi) -
määräytyy atomin kyvyn muodostaa
rajoitettu määrä yhteyksiä (ottaen huomioon molemmat
muodostumismekanismit).
Sidoksen suunta määräytyy sidoskulman mukaan, joka riippuu
keskusatomin orbitaalien hybridisaatiotyyppi.
Ionisidos: tyydyttymätön ja suuntaamaton. Ioni- ja kovalenttisten ominaisuuksien vertailu
polaariset sidokset
Sidossuunta määräytyy sidoskulmien mukaan.
Sidoskulmat määritetään kokeellisesti tai
ennustettu hybridisaatioteorian perusteella
L. Paullingin atomikiertoradat tai teoria
Gillespie.
Tästä lisää seminaareissa.
kovalenttiset sidokset
Kovalenttiset sidokset
Atomikiteitä
Atomien välissä
itse kristallissa
Korkea kovuus
korkea sulamispiste, kiehuva
huono kuumuus ja
sähkönjohtavuus
Molekyylikiteet
Atomien välissä
molekyylissä
Kohtalainen pehmeys
melko alhainen
sulaa, kiehauta
huono kuumuus ja
Sähkönjohtavuus
Ei liukene veteen Aineiden ominaisuuksien vertailu ionisten ja
kovalenttiset sidokset
molekyylikide
Sulamispiste 112,85 °C Aineiden ominaisuuksien vertailu ionisten ja
kovalenttiset sidokset
Atomi kovalenttinen kristalli
Sulamispiste ≈ 3700 °C Aineiden ominaisuuksien vertailu ionisten ja
kovalenttiset sidokset
Ioniset sidokset
ionien välillä
kristallissa
kovuus ja hauraus
korkea sulamispiste
huono lämmön- ja sähkönjohtavuus
Liukenee veteen Aineiden ominaisuuksien vertailu ionisten ja
kovalenttiset sidokset
Ioninen kristalli
Sulamispiste ≈ 800 °C Metalliliitäntä
Metalliset sidokset suoritetaan elektronien avulla,
kuuluvat kaikkiin atomeihin samanaikaisesti.
Elektronien tiheys
"elektronikaasu" on siirretty.
Ominaista
metallinen kiilto
Muovi
Taipuisuus
Korkea lämpö ja
sähkönjohtavuus
Sulamispisteet
todella erilainen. Molekyylien väliset sidokset.
1. Vetysidos
Yhden vetyatomin (+) välinen vetovoima
molekyyli ja toisen molekyylin F, O, N (–)-atomi
F
F
H
H
H
H
F
F
O
H3C
H
F
C
H
Polymeeri
(HF)n
O
C
O
H
CH3
Dimer
etikkahappo
O
Vetysidokset ovat heikkoja yksittäin,
mutta vahva kollektiivisesti Molekyylien väliset sidokset.
2. Vetysidos DNA:ssa Molekyylien väliset sidokset.
3. Vetysidokset vedessä
nestemäistä vettä
jäätä Molekyylien väliset sidokset.
4. Vetysidosten muodostuminen sisään
vettä
nestemäistä vettä
muunnos
vesi jääksi Molekyylien väliset sidokset.
5. Van der Waalsin liitännät
Vaikka molekyylien välillä ei olisi vetysidoksia,
molekyylit vetoavat aina toisiinsa.
Molekyylidipolien välistä vetovoimaa kutsutaan van der Waalsin kytkennäksi.
Mitä voimakkaampi vetovoima:
1) napaisuus; 2) molekyylikoko.
Esimerkki: metaani (CH4) – kaasu, bentseeni (C6H6) – neste
Yksi heikoimmista c-d-v-sidoksista on molekyylien välillä
H2 (sp. –259 oC, kp. –253 oC).
Molekyylien välinen vuorovaikutus on monta kertaa heikompi kuin atomien välinen sidos:
Ekow(Cl–Cl) = 244 kJ/mol, Evdv(Cl2–Cl2) = 25 kJ/mol
mutta juuri tämä varmistaa nestemäisen ja kiinteän aineen olemassaolon Luennolla käytettiin professorin materiaalia
Moskovan valtionyliopiston kemian tiedekunta. Lomonosov
Eremin Vadim Vladimirovich
Kiitos
huomionne!
Aineiden ominaisuuksien riippuvuus molekyylien rakenteesta
Oppitunti avoimissa mielissä
Tavoitteet. Koulutus – vahvistaa ja syventää opiskelijoiden tietämystä kemiallisen rakenteen teoriasta ja sen perusperiaatteista.
Koulutuksellinen– edistää syy-seuraus-suhteiden ja -suhteiden muodostumista.
Kehittäviä– ajattelutaitojen kehittäminen, kyky siirtää tietoa ja taitoja uusiin tilanteisiin.
Laitteet ja reagenssit. Sarja pallo- ja tikkumalleja; näytteitä luonnon- ja synteettisestä kumista, dietyylieetteristä, butanolista, etanolista, fenolista, litiumista, natriumista, lakmusliuoksesta, bromivedestä, muurahais- ja etikkahaposta.
Motto."Jokaisella aineella - yksinkertaisimmasta monimutkaisimpiin - on kolme erilaista, mutta toisiinsa liittyvää näkökohtaa - ominaisuus, koostumus, rakenne."(V.M. Kedrov).
TUTKIEN AIKANA
Mitä käsite "riippuvuus" sisältää? (Tutki opiskelijoiden mielipiteet).
Kirjoita taululle määritelmä: ”Riippuvuus on
1) ilmiön suhde toiseen syyn seurauksena;
2) alistuminen muille riippumattomuuden, vapauden puuttuessa” (S.I. Ozhegovin sanakirja).
Määritämme yhdessä oppitunnin tavoitteet laatimalla kaavion:
Motivaatio-orientaatio lohko
Älyllinen lämmittely
Selvitä alla olevien väitteiden oikeellisuus ja tue vastauksiasi esimerkein.
Kemiallisen rakenteen teorian löysi D. I. Mendeleev.
Vastaus. A. M. Butlerov, 1861
Orgaanisten yhdisteiden hiilen valenssi voi olla II ja IV.
Vastaus. Hiilen valenssi on useimmiten IV.
Orgaanisten aineiden molekyylit muodostavat atomit liittyvät satunnaisesti valenssista välittämättä.
Vastaus. Molekyylien atomit ovat sitoutuneet tiettyyn sekvenssiin valenssinsa mukaan.
Aineiden ominaisuudet eivät riipu molekyylien rakenteesta.
Vastaus. Butlerov väitti kemiallisen rakenteen teoriassa, että orgaanisten yhdisteiden ominaisuudet määräytyvät niiden molekyylien koostumuksen ja rakenteen perusteella.
Toiminta- ja suoritusyksikkö
Tilarakennetekijä
Mitä tiedät alkaanien ja alkeenien molekyylien tilarakenteesta?
Vastaus. Alkaaneissa jokaisessa hiilessä on neljä vierekkäistä atomia, jotka sijaitsevat tetraedrin huipuissa. Itse hiili sijaitsee tetraedrin keskellä. Hiiliatomihybridisaation tyyppi - sp 3, sidosten väliset kulmat (H–C–C, H–C–H, C–C–C) - 109°28". Hiiliketjun rakenne on siksak.
Alkeeneissa kaksi kaksoissidoksella yhdistettyä hiiliatomia ja neljä atomia yksinkertaisilla sidoksilla ovat samassa tasossa. Atomihybridisaation tyyppi - sp 2, sidosten väliset kulmat (H–C=C, C–C=C) - 120°.
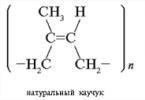
Muista luonnonkumin ja synteettisen kumin molekyylien avaruudellisen rakenteen välinen ero.
Vastaus. Luonnonkumilla, lineaarisella isopreenin polymeerillä, on rakenne IVY-1,4-polyisopreeni. Synteettisellä kumilla voi olla rakenne transsi-1,4-polyisopreeni.

Ovatko nämä kumit samaa elastisuutta?
Vastaus. Cis-muoto on joustavampi kuin muunnosmuoto. Luonnonkumin molekyylit ovat pidempiä ja kimmoisemmin kierrettyjä (ensin spiraaliksi ja sitten palloksi) kuin synteettisen kumin molekyylit.
Tärkkelys (C 5 H 10 O 5) m on valkoinen amorfinen jauhe ja selluloosa (C 5 H 10 O 5) n on kuituaine.
Mistä tämä ero johtuu?
Vastaus. Tärkkelys on -glukoosipolymeeri, kun taas selluloosa on -glukoosipolymeeri.

Ovatko tärkkelyksen ja selluloosan kemialliset ominaisuudet erilaisia?
Vastaus. Tärkkelys + I 2 sininen liuos,
selluloosa + HNO 3 -nitroselluloosa.
Johtopäätös. Sekä fysikaaliset että kemialliset ominaisuudet riippuvat tilarakenteesta.
Kemiallinen rakennetekijä
Mikä on kemiallisen rakenteen teorian pääidea?
Vastaus. Kemiallinen rakenne heijastaa aineiden ominaisuuksien riippuvuutta atomien liittymisjärjestyksestä ja niiden vuorovaikutuksesta.
Selvitä, mitä yhteistä aineilla on:
Vastaus. Yhdiste.
Vertaa näiden aineiden fysikaalisia ominaisuuksia. Mikä on mielestäsi syy tähän eroon?
Mikä molekyyli on polaarisempi kemiallisen sidoksen elektronitiheyden jakauman perusteella? Mihin tämä liittyy?
Vastaus. –OH vetysidos.
Esittelykokeilu

Johtopäätös. Alkoholin reaktiivisuus määräytyy molekyylin atomien keskinäisen vaikutuksen perusteella.
Elektroninen rakennetekijä
Mikä on atomien keskinäisen vaikutuksen ydin?
Vastaus. Keskinäinen vaikutus muodostuu atomien elektronisten rakenteiden vuorovaikutuksesta, mikä johtaa kemiallisten sidosten elektronitiheyden muuttumiseen.
Laboratoriotyöt
Opettaja. Pöydilläsi on laboratoriopakkauksia. Suorita tehtävä ja todista kokeellisesti aineiden ominaisuuksien riippuvuus elektronirakenteesta. Työskennellä pareittain. Noudata tarkasti turvallisuusmääräyksiä.
Vaihtoehto I. Tee tutkimusta etanolin ja fenolin kemiallisista ominaisuuksista. Todista niiden reaktiivisuuden riippuvuus niiden elektronisesta rakenteesta. Käytä reagensseja - litiummetallia ja bromivettä. Kirjoita mahdollisten reaktioiden yhtälöt ylös. Näytä kemiallisen sidoksen elektronitiheyden muutos molekyyleissä.
Vaihtoehto II. Selitä karboksyyliryhmän –COOH ja karbonyylihiilessä olevan substituentin keskinäisen vaikutuksen ydin karboksyylihappomolekyyleissä. Harkitse esimerkkiä muurahais- ja etikkahaposta. Käytä lakmus- ja litiumliuosta. Kirjoita reaktioyhtälöt muistiin. Näytä kemiallisen sidoksen elektronitiheyden muutos molekyyleissä.
Johtopäätös. Kemialliset ominaisuudet riippuvat atomien keskinäisestä vaikutuksesta.


Lopullinen tiedon hallinta
Opettaja. Tehdään yhteenveto oppitunnistamme. Olemme vahvistaneet, että aineiden ominaisuudet riippuvat tilakemiallisesta ja elektronisesta rakenteesta.
1. Kirjoita kaavat HCOOH, C 6 H 5 OH ja C 4 H 9 COOH aineiden happamien ominaisuuksien lisääntymisjärjestykseen.
2. Järjestä kaavat CH 3 COOH, C 3 H 7 COOH, CH 3 OH, ClCH 2 COOH aineiden happamien ominaisuuksien mukaan laskevaan järjestykseen.
3. Missä aldehydissä on:

aktiivisempi aldehydiryhmä? Miksi?
Arvioi työsi luokassa.
L.A.EREMINA,
kemian opettaja koulussa 24
(Abakan, Khakassia)
Kovalenttinen kemiallinen sidos, sen lajikkeet ja muodostumismekanismit. Kovalenttisten sidosten ominaisuudet (napaisuus ja sidosenergia). Ionisidos. Metalliliitäntä. Vetysidos
Kemiallisen sidoksen oppi on kaiken teoreettisen kemian perusta.
Kemiallinen sidos ymmärretään atomien vuorovaikutukseksi, joka sitoo ne molekyyleiksi, ioneiksi, radikaaleiksi ja kiteiksi.
Kemiallisia sidoksia on neljää tyyppiä: ioniset, kovalenttiset, metalliset ja vetysidokset.
Kemiallisten sidosten jakaminen tyyppeihin on ehdollista, koska niille kaikille on ominaista tietty yhtenäisyys.
Ionisidosta voidaan pitää polaarisen kovalenttisen sidoksen ääritapauksena.
Metallisidos yhdistää atomien kovalenttisen vuorovaikutuksen yhteisten elektronien avulla ja sähköstaattisen vetovoiman näiden elektronien ja metalli-ionien välillä.
Aineilta puuttuu usein rajoittavia tapauksia kemiallisesta sitoutumisesta (tai puhtaasta kemiallisesta sitoutumisesta).
Esimerkiksi litiumfluoridi $LiF$ luokitellaan ioniyhdisteeksi. Itse asiassa siinä oleva sidos on $80%$ ioninen ja $20%$ kovalenttinen. Siksi on luonnollisesti oikeampaa puhua kemiallisen sidoksen polariteettiasteesta (ionisyydestä).
Vetyhalogenidien sarjassa $HF—HCl—HBr—HI—HAt$ sidoksen polariteettiaste pienenee, koska halogeeni- ja vetyatomien elektronegatiivisuusarvojen ero pienenee ja astatiinivedyssä sidos muuttuu lähes polaarittomaksi. $(EO(H) = 2,1; EO(At) = 2,2) $.
Samoista aineista löytyy erityyppisiä sidoksia, esimerkiksi:
- emäksissä: hydroksoryhmien happi- ja vetyatomien välillä sidos on polaarinen kovalenttinen, ja metallin ja hydroksoryhmän välillä se on ioninen;
- happea sisältävien happojen suoloissa: ei-metalliatomin ja happaman jäännöksen hapen välillä - kovalenttinen polaarinen ja metallin ja happaman tähteen välillä - ioninen;
- ammoniumissa, metyyliammoniumsuoloissa jne.: typpi- ja vetyatomien välillä - kovalenttinen polaarinen ja ammonium- tai metyyliammoniumionien ja happojäännöksen välillä - ioninen;
- metalliperoksideissa (esimerkiksi $Na_2O_2$) happiatomien välinen sidos on kovalenttinen ei-polaarinen, ja metallin ja hapen välinen sidos on ioninen jne.
Erityyppiset yhteydet voivat muuttua toisikseen:
- kovalenttisten yhdisteiden elektrolyyttisessä dissosiaatiossa vedessä kovalenttinen polaarinen sidos muuttuu ionisidokseksi;
- metallien haihtuessa metallisidos muuttuu ei-polaariseksi kovalenttiseksi sidokseksi jne.
Syy kaikentyyppisten ja tyyppisten kemiallisten sidosten yhtenäisyyteen on niiden identtinen kemiallinen luonne - elektroni-ydinvuorovaikutus. Kemiallisen sidoksen muodostuminen on joka tapauksessa seurausta atomien elektroni-ydinvuorovaikutuksesta, johon liittyy energian vapautuminen.
Kovalenttisten sidosten muodostamismenetelmät. Kovalenttisen sidoksen ominaisuudet: sidoksen pituus ja energia
Kovalenttinen kemiallinen sidos on sidos, joka muodostuu atomien välille yhteisten elektroniparien muodostumisen kautta.
Tällaisen sidoksen muodostumismekanismi voi olla vaihto- tai luovuttaja-akseptori.
minä Vaihtomekanismi toimii, kun atomit muodostavat yhteisiä elektronipareja yhdistämällä parittomia elektroneja.
1) $H_2$ - vety:
Sidos syntyy, koska vetyatomien $s$-elektronit muodostavat yhteisen elektroniparin (päällekkäiset $s$-orbitaalit):

2) $HCl$ - kloorivety:
Sidos syntyy, kun muodostuu yhteinen elektronipari $s-$ ja $p-$ elektroneja (päällekkäiset $s-p-$-orbitaalit):
3) $Cl_2$: kloorimolekyylissä muodostuu kovalenttinen sidos pariutumattomien $p-$elektronien (päällekkäisten $p-p-$orbitaalien) vuoksi:

4) $N_2$: typpimolekyylissä atomien väliin muodostuu kolme yhteistä elektroniparia:
II. Luovuttaja-akseptori -mekanismi Tarkastellaan kovalenttisen sidoksen muodostumista ammoniumionin $NH_4^+$ esimerkillä.

Luovuttajalla on elektronipari, akseptorilla on tyhjä orbitaali, jonka tämä pari voi miehittää. Ammoniumionissa kaikki neljä sidosta vetyatomien kanssa ovat kovalenttisia: kolme muodostui, koska typpiatomi ja vetyatomit muodostivat yhteiset elektroniparit vaihtomekanismin mukaisesti, yksi - luovuttaja-akseptorimekanismin kautta.
Kovalenttiset sidokset voidaan luokitella sen mukaan, miten elektroniradat menevät päällekkäin, sekä sen mukaan, miten ne siirtyvät kohti yhtä sitoutuneista atomeista.
Kemiallisia sidoksia, jotka muodostuvat limittäisten elektronien kiertoradan seurauksena sidosviivaa pitkin, kutsutaan $σ$ -obligaatiot (sigma-obligaatiot). Sigma-sidos on erittäin vahva.

$p-$-orbitaalit voivat mennä päällekkäin kahdella alueella muodostaen kovalenttisen sidoksen sivuttaisen päällekkäisyyden vuoksi:

Kemialliset sidokset, jotka muodostuvat viestintälinjan ulkopuolella olevien elektronien kiertoradan "sivuttaisen" päällekkäisyyden seurauksena, ts. kahdella alueella kutsutaan $π$ -obligaatiot (pi-bonds).
Tekijä: siirtymäaste jaetut elektroniparit yhteen atomeista, joihin ne sitoutuvat, kovalenttinen sidos voi olla napainen Ja ei-polaarinen.
Kovalenttista kemiallista sidosta, joka muodostuu atomien välille, joilla on sama elektronegatiivisuus, kutsutaan ei-polaarinen. Elektronipareja ei siirretä mihinkään atomiin, koska atomeilla on sama EO - ominaisuus houkutella valenssielektroneja muista atomeista. Esimerkiksi:
nuo. yksinkertaisten ei-metallisten aineiden molekyylejä muodostuu kovalenttisten ei-polaaristen sidosten kautta. Kovalenttista kemiallista sidosta alkuaineiden atomien välillä, joiden elektronegatiivisuus vaihtelee, kutsutaan napainen.
Kovalenttisten sidosten pituus ja energia.
Ominaista kovalenttisen sidoksen ominaisuudet- sen pituus ja energia. Linkin pituus on atomiytimien välinen etäisyys. Mitä lyhyempi kemiallinen sidos on, sitä vahvempi se on. Yhteyden vahvuuden mitta on kuitenkin sitovaa energiaa, jonka määrää sidoksen katkaisemiseen tarvittava energiamäärä. Se mitataan yleensä kJ/molissa. Siten kokeellisten tietojen mukaan $H_2-, Cl_2$- ja $N_2$-molekyylien sidospituudet ovat vastaavasti $0,074, 0,198 $ ja $0,109 $ nm, ja sidosenergiat ovat vastaavasti $436, 242 $ ja $946 $ kJ/mol.
ionit. Ionisidos
Kuvitellaan, että kaksi atomia "kohtaavat": ryhmän I metallin atomi ja ryhmän VII ei-metalliatomi. Metalliatomilla on yksi elektroni ulkoisella energiatasolla, kun taas ei-metalliatomilta puuttuu vain yksi elektroni, jotta sen ulkotaso olisi täydellinen.
Ensimmäinen atomi antaa helposti toiselle elektroninsa, joka on kaukana ytimestä ja heikosti sitoutunut siihen, ja toinen antaa sille vapaan paikan ulommalle elektronitasolle.
Sitten atomista, jolta on poistettu yksi negatiivisista varauksista, tulee positiivisesti varautunut hiukkanen, ja toinen muuttuu negatiivisesti varautuneeksi hiukkaseksi tuloksena olevan elektronin ansiosta. Tällaisia hiukkasia kutsutaan ioneja.
Ionien välillä muodostuvaa kemiallista sidosta kutsutaan ioniseksi.
Tarkastellaan tämän sidoksen muodostumista käyttämällä esimerkkiä hyvin tunnetusta yhdisteestä natriumkloridi (pöytäsuola):
Prosessi atomien muuntamiseksi ioneiksi on kuvattu kaaviossa:

Tämä atomien muuttuminen ioneiksi tapahtuu aina tyypillisten metallien ja tyypillisten epämetallien atomien vuorovaikutuksessa.
Tarkastellaan päättelyn algoritmia (sekvenssiä) tallennettaessa ionisidoksen muodostumista esimerkiksi kalsium- ja klooriatomien välillä:

Numeroita, jotka osoittavat atomien tai molekyylien lukumäärän, kutsutaan kertoimet, ja numeroita, jotka osoittavat atomien tai ionien lukumäärän molekyylissä, kutsutaan indeksit.
Metalliliitäntä
Tutustutaan siihen, kuinka metallielementtien atomit ovat vuorovaikutuksessa keskenään. Metallit eivät yleensä ole eristettyinä atomeina, vaan kappaleen, harkon tai metallituotteen muodossa. Mikä pitää metalliatomit yhdessä tilavuudessa?
Useimpien metallien atomit sisältävät pienen määrän elektroneja ulkotasolla - $ 1, 2, 3 $. Nämä elektronit irrotetaan helposti ja atomeista tulee positiivisia ioneja. Irronneet elektronit liikkuvat ionista toiseen sitoen ne yhdeksi kokonaisuudeksi. Yhdistämällä ioneihin nämä elektronit muodostavat väliaikaisesti atomeja, sitten katkeavat uudelleen ja yhdistyvät toiseen ioniin jne. Näin ollen metallin tilavuudessa atomit muuttuvat jatkuvasti ioneiksi ja päinvastoin.
Metallien sidosta ionien välillä yhteisten elektronien kautta kutsutaan metalliksi.
Kuvassa on kaavamaisesti esitetty natriummetallifragmentin rakenne.

Tässä tapauksessa pieni määrä yhteisiä elektroneja sitoo suuren määrän ioneja ja atomeja.

Metallisella sidoksella on joitain yhtäläisyyksiä kovalenttisen sidoksen kanssa, koska se perustuu ulkoisten elektronien jakamiseen. Kovalenttisella sidoksella kuitenkin vain kahden vierekkäisen atomin ulommat parittomat elektronit jaetaan, kun taas metallisidoksessa kaikki atomit osallistuvat näiden elektronien jakamiseen. Siksi kovalenttisella sidoksella varustetut kiteet ovat hauraita, mutta metallisidoksella ne ovat yleensä sitkeitä, sähköä johtavia ja niillä on metallinen kiilto.
Metallisidos on ominaista sekä puhtaille metalleille että eri metallien seoksille - kiinteissä ja nestemäisissä seoksissa.
Vetysidos
Kemiallinen sidos yhden molekyylin (tai sen osan) positiivisesti polarisoituneiden vetyatomien ja vahvasti elektronegatiivisten elementtien negatiivisesti polarisoituneiden atomien välillä, joissa on toisen molekyylin yksittäisiä elektronipareja ($F, O, N$ ja harvemmin $S$ ja $Cl$) (tai sen osaa) kutsutaan vedyksi.
Vetysidoksen muodostumismekanismi on luonteeltaan osittain sähköstaattinen, osittain luovuttaja-akseptori.
Esimerkkejä molekyylien välisestä vetysidoksesta:
Tällaisen liitoksen läsnäollessa pienimolekyylisetkin aineet voivat normaaleissa olosuhteissa olla nesteitä (alkoholi, vesi) tai helposti nesteytettyjä kaasuja (ammoniakki, fluorivety).
Aineilla, joissa on vetysidoksia, on molekyylikidehilat.
Molekyyli- ja ei-molekyylirakenteiset aineet. Kidehilan tyyppi. Aineiden ominaisuuksien riippuvuus niiden koostumuksesta ja rakenteesta
Aineiden molekyylirakenne ja ei-molekyylirakenne
Kemiallisiin vuorovaikutuksiin eivät pääse yksittäiset atomit tai molekyylit, vaan aineet. Tietyissä olosuhteissa aine voi olla jossakin kolmesta aggregaatiotilasta: kiinteä, nestemäinen tai kaasumainen. Aineen ominaisuudet riippuvat myös sen muodostavien hiukkasten - molekyylien, atomien tai ionien - välisen kemiallisen sidoksen luonteesta. Sidostyypin perusteella erotetaan molekyylirakenteen ja ei-molekyylirakenteen aineet.
Molekyyleistä koostuvia aineita kutsutaan molekyyliset aineet. Tällaisten aineiden molekyylien väliset sidokset ovat erittäin heikkoja, paljon heikompia kuin molekyylin sisällä olevien atomien välillä, ja jopa suhteellisen alhaisissa lämpötiloissa ne hajoavat - aine muuttuu nesteeksi ja sitten kaasuksi (jodin sublimaatio). Molekyyleistä koostuvien aineiden sulamis- ja kiehumispisteet nousevat molekyylipainon kasvaessa.
Molekyyliaineisiin kuuluvat atomirakenteen omaavat aineet ($C, Si, Li, Na, K, Cu, Fe, W$), niiden joukossa on metalleja ja ei-metalleja.
Tarkastellaan alkalimetallien fysikaalisia ominaisuuksia. Suhteellisen alhainen atomien välinen sidoslujuus aiheuttaa alhaisen mekaanisen lujuuden: alkalimetallit ovat pehmeitä ja niitä voidaan leikata helposti veitsellä.
Suuret atomikoot johtavat alkalimetallien pieniin tiheyksiin: litium, natrium ja kalium ovat jopa vettä kevyempiä. Alkalimetallien ryhmässä kiehumis- ja sulamispisteet laskevat alkuaineen atomiluvun kasvaessa, koska Atomien koot kasvavat ja sidokset heikkenevät.
Aineille ei-molekyylinen rakenteet sisältävät ionisia yhdisteitä. Useimmilla metalliyhdisteillä epämetallien kanssa on tämä rakenne: kaikki suolat ($NaCl, K_2SO_4$), jotkut hydridit ($LiH$) ja oksidit ($CaO, MgO, FeO$), emäkset ($NaOH, KOH$). Ionisilla (ei-molekyylisillä) aineilla on korkea sulamis- ja kiehumispiste.
Kristallihilat
Aine voi, kuten tiedetään, esiintyä kolmessa aggregaatiotilassa: kaasumaisessa, nestemäisessä ja kiinteässä.
Kiinteät aineet: amorfinen ja kiteinen.
Tarkastellaan kuinka kemiallisten sidosten ominaisuudet vaikuttavat kiinteiden aineiden ominaisuuksiin. Kiinteät aineet jaetaan kiteinen Ja amorfinen.
Amorfisilla aineilla ei ole selkeää sulamispistettä kuumennettaessa, ne pehmenevät vähitellen ja muuttuvat nestemäiseksi. Esimerkiksi muovailuvaha ja erilaiset hartsit ovat amorfisessa tilassa.
Kiteisille aineille on ominaista niiden hiukkasten oikea järjestely, joista ne koostuvat: atomit, molekyylit ja ionit - tiukasti määritellyissä avaruuden pisteissä. Kun nämä pisteet yhdistetään suorilla viivoilla, muodostuu avaruudellinen kehys, jota kutsutaan kidehilaksi. Pisteitä, joissa kidehiukkaset sijaitsevat, kutsutaan hilasolmuiksi.
Riippuen kidehilan solmuissa sijaitsevien hiukkasten tyypistä ja niiden välisen yhteyden luonteesta, erotetaan neljä kidehilaa: ioninen, atomi, molekyyli Ja metalli.
Ioniset kidehilat.
Ioninen kutsutaan kidehiloiksi, joiden solmuissa on ioneja. Ne muodostuvat aineista, joissa on ionisia sidoksia, jotka voivat sitoa sekä yksinkertaisia ioneja $Na^(+), Cl^(-)$ että kompleksisia $SO_4^(2−), OH^-$. Näin ollen suoloilla ja joillakin metallien oksideilla ja hydroksideilla on ionikidehilat. Esimerkiksi natriumkloridikide koostuu vuorotellen positiivisista $Na^+$ ja negatiivisista $Cl^-$-ioneista, jotka muodostavat kuution muotoisen hilan. Ionien väliset sidokset tällaisessa kiteessä ovat erittäin stabiileja. Siksi aineille, joilla on ionihila, on ominaista suhteellisen korkea kovuus ja lujuus, ne ovat tulenkestäviä ja haihtumattomia.

Atomikidehilat.
Atomi kutsutaan kidehiloiksi, joiden solmuissa on yksittäisiä atomeja. Tällaisissa hilassa atomit ovat yhteydessä toisiinsa erittäin vahvoilla kovalenttisilla sidoksilla. Esimerkki aineista, joissa on tämäntyyppisiä kidehiloja, on timantti, yksi hiilen allotrooppisista muunnelmista.
Useimmilla aineilla, joissa on atomikidehila, on erittäin korkeat sulamispisteet (esimerkiksi timantilla se on yli $3500°C), ne ovat vahvoja ja kovia ja käytännössä liukenemattomia.

Molekyylikidehilat.
Molekyyli kutsutaan kidehiloiksi, joiden solmuissa molekyylit sijaitsevat. Kemialliset sidokset näissä molekyyleissä voivat olla sekä polaarisia ($HCl, H_2O$) että ei-polaarisia ($N_2, O_2$). Huolimatta siitä, että molekyylien sisällä olevat atomit ovat yhteydessä toisiinsa erittäin vahvoilla kovalenttisilla sidoksilla, heikot molekyylien väliset vetovoimat vaikuttavat molekyylien itsensä välillä. Siksi aineilla, joissa on molekyylikidehilat, on alhainen kovuus, alhaiset sulamispisteet ja ne ovat haihtuvia. Useimmilla kiinteillä orgaanisilla yhdisteillä on molekyylikidehilat (naftaleeni, glukoosi, sokeri).

Metalliset kidehilat.
Aineilla, joissa on metallisidoksia, on metalliset kidehilat. Tällaisten hilojen kohdissa on atomeja ja ioneja (joko atomeja tai ioneja, joihin metalliatomit muuttuvat helposti luovuttaen ulkoelektronejaan "yhteiskäyttöön"). Tämä metallien sisäinen rakenne määrää niille ominaiset fysikaaliset ominaisuudet: muokattavuuden, sitkeyden, sähkön ja lämmönjohtavuuden, ominaisen metallisen kiillon.
Elektronegatiivisuus on kemiallisen alkuaineen ominaisuus houkutella elektroneja atomiinsa muiden alkuaineiden atomeista, joiden kanssa tämä alkuaine muodostaa kemiallisen sidoksen yhdisteissä.
Kun eri alkuaineiden atomien välille muodostuu kemiallinen sidos, yhteinen elektronipilvi siirtyy elektronegatiivisempaan atomiin, minkä vuoksi sidoksesta tulee kovalenttisesti polaarinen ja jos elektronegatiivisuuden ero on suuri, se muuttuu ioniseksi.
Elektronegatiivisuus otetaan huomioon kemiallisia kaavoja kirjoitettaessa: binääriyhdisteissä elektronegatiivisimman alkuaineen symboli kirjoitetaan taakse.
Elektronegatiivisuus kasvaa vasemmalta oikealle kunkin jakson elementtien osalta ja pienenee ylhäältä alas saman PS-ryhmän elementtien osalta.
Valenssi Alkuaine on atomiensa ominaisuus yhdistyä tietyn määrän muita atomeja.
On stoikiometrinen, elektroninen valenssi ja koordinaationumero. Otamme huomioon vain stoikiometrisen valenssin.
Stökiömetrinen Valenssi osoittaa, kuinka monta toisen alkuaineen atomia on kiinnittynyt tietyn alkuaineen atomiin. Vedyn valenssi otetaan valenssin yksiköksi, koska vety on aina yksiarvoinen. Esimerkiksi yhdisteissä HCl, H 2 O, NH 3 (ammoniakin H 3 N oikeaa kirjoitusasua käytetään jo nykyaikaisissa oppikirjoissa) CH 4 kloori on yksiarvoinen, happi kaksiarvoinen, typpi on kolmiarvoinen ja hiili neliarvoinen.
Hapen stoikiometrinen valenssi on yleensä 2. Koska lähes kaikki alkuaineet muodostavat yhdisteitä hapen kanssa, on sitä kätevää käyttää standardina toisen alkuaineen valenssin määrittämisessä. Esimerkiksi yhdisteissä Na 2O, CoO, Fe 2O 3, SO 3 natrium on yksiarvoinen, koboltti on kaksiarvoinen, rauta on kolmiarvoinen, rikki on kuusiarvoinen.
Redox-reaktioissa meille on tärkeää määrittää alkuaineiden hapetustilat.
Hapetustila Aineen alkuaineen arvoa kutsutaan sen stoikiometriseksi valenssiksi plus- tai miinusmerkillä otettuna.
Kemialliset alkuaineet jaetaan vakiovalenssiin ja vaihtelevan valenssin elementteihin.
1.3.3. Molekyyli- ja ei-molekyylirakenteiset aineet. Kidehilan tyyppi. Aineiden ominaisuuksien riippuvuus niiden koostumuksesta ja rakenteesta.
Riippuen siitä, missä tilassa yhdisteet esiintyvät luonnossa, ne jaetaan molekyylisiin ja ei-molekyylisiin. Molekyyliaineissa pienimmät rakenteelliset hiukkaset ovat molekyylejä. Näillä aineilla on molekyylikidehila. Ei-molekyylisissä aineissa pienimmät rakenteelliset hiukkaset ovat atomeja tai ioneja. Niiden kidehila on atomi-, ioni- tai metallinen.
Kidehilan tyyppi määrää suurelta osin aineiden ominaisuudet. Esimerkiksi metallit, joissa on metallihilan tyyppi, eroaa kaikista muista elementeistä korkea sitkeys, sähkön- ja lämmönjohtavuus. Nämä ominaisuudet, samoin kuin monet muut - muokattavuus, metallinen kiilto jne. ne johtuvat erityisestä metalliatomien välisestä sidoksesta - metallinen liitos. On huomattava, että metalleille ominaiset ominaisuudet näkyvät vain kondensoituneessa tilassa. Esimerkiksi hopealla kaasumaisessa tilassa ei ole metallien fysikaalisia ominaisuuksia.
Metallien erityinen sidostyyppi – metalli – johtuu valenssielektronien puutteesta, joten ne ovat yhteisiä koko metallin rakenteelle. Yksinkertaisin metallien rakenteen malli olettaa, että metallien kidehila koostuu positiivisista ioneista, joita ympäröivät vapaat elektronit, elektronien liike tapahtuu kaoottisesti, kuten kaasumolekyylit. Tällainen malli, vaikka se selittää kvalitatiivisesti monia metallien ominaisuuksia, osoittautuu kuitenkin kvantitatiivisesti testattuna riittämättömäksi. Metallisen tilan teorian jatkokehitys johti luomiseen metallien nauhateoria, joka perustuu kvanttimekaniikan käsitteisiin.
Kidehilan kohdat sisältävät kationeja ja metalliatomeja, ja elektronit liikkuvat vapaasti läpi kidehilan.
Metallien tyypillinen mekaaninen ominaisuus on muovi, johtuen niiden kiteiden sisäisen rakenteen erityispiirteistä. Plastisuus ymmärretään ulkoisten voimien vaikutuksesta olevien kappaleiden kyvyksi muuttaa muotoaan, joka säilyy myös ulkoisen vaikutuksen lakkaamisen jälkeen. Tämän metallien ominaisuuden ansiosta ne voidaan muotoilla eri muotoisiksi takomisen aikana, metalli voidaan valssata levyiksi tai vetää langaksi.
Metallien plastisuus johtuu siitä, että ulkoisen vaikutuksen alaisena kidehilan muodostavat ionikerrokset siirtyvät suhteessa toisiinsa rikkoutumatta. Tämä johtuu siitä, että siirretyt elektronit jatkavat kommunikointia ionikerrosten välillä vapaan uudelleenjakautumisen vuoksi. Kun kiinteään aineeseen, jossa on atomihila, kohdistetaan mekaaninen vaikutus, sen yksittäiset kerrokset siirtyvät ja niiden välinen adheesio katkeaa kovalenttisten sidosten katkeamisen vuoksi.
ioneja, silloin nämä aineet muodostuvat ionityyppinen kidehila.


Nämä ovat suoloja sekä tyypillisten metallien oksideja ja hydroksideja. Nämä ovat kovia, hauraita aineita, mutta niiden tärkein laatu on : näiden yhdisteiden liuokset ja sulat johtavat sähkövirtaa.
Jos kidehilan solmut sisältävät atomeja, silloin nämä aineet muodostuvat atomityyppinen kidehila(timantti, boori, pii, alumiini ja piioksidit). Ominaisuudet ovat erittäin kovia ja tulenkestäviä, veteen liukenemattomia.
Jos kidehilan solmut sisältävät molekyylejä, sitten näitä aineita muodostuu (normaaliolosuhteissa kaasuja ja nesteitä: O 2, HCl; I 2 orgaaniset aineet).
On mielenkiintoista huomata metalligallium, joka sulaa 30 o C:n lämpötilassa. Tämä poikkeama selittyy sillä, että Ga 2 -molekyylit sijaitsevat kidehilan solmukohdissa ja sen ominaisuudet tulevat samanlaisiksi kuin aineet, joilla on molekyyli. kristallihila.

Esimerkki. Kaikilla ryhmän ei-metalleilla on ei-molekyylirakenne:
1) hiili, boori, pii; 2) fluori, bromi, jodi;
3) happi, rikki, typpi; 4) klooria, fosforia, seleeniä.
Ei-molekyylisissä aineissa pienimmät rakenteelliset hiukkaset ovat atomeja tai ioneja. Niiden kidehila on atomi-, ioni- tai metallinen
klo päätös Tätä kysymystä on helpompi lähestyä päinvastaisesta suunnasta. Jos kidehilan solmut sisältävät molekyylejä, silloin nämä aineet muodostuvat kidehilan molekyylityyppi(normaaliolosuhteissa kaasut ja nesteet: O 2, HCl; myös I 2, ortorombinen rikki S 8, valkoinen fosfori P 4, orgaaniset aineet). Ominaisuudeltaan nämä ovat hauraita, sulavia yhdisteitä.
Toinen vastaus sisältää fluorikaasua, kolmas sisältää happi- ja typpikaasuja ja neljäs sisältää kloorikaasua. Tämä tarkoittaa, että näillä aineilla on molekyylikidehila ja molekyylirakenne.
SISÄÄN ensimmäinen Vastaus on, että kaikki aineet ovat normaaleissa olosuhteissa kiinteitä yhdisteitä ja muodostavat atomihilan, mikä tarkoittaa, että niillä on ei-molekyylirakenne.
Oikea vastaus:1) hiili, boori, pii
Luento: Molekyyli- ja ei-molekyylirakenteiset aineet. Kidehilan tyyppi. Aineiden ominaisuuksien riippuvuus niiden koostumuksesta ja rakenteesta
Molekyyliset ja ei-molekyyliset aineet
Rakenteensa mukaan kemialliset aineet jaetaan kahteen ryhmään: molekyyleistä koostuvia kutsutaan molekyylinen ja sisältää atomeja ja ioneja - ei-molekyylinen.
Molekyyliaineilla on alhaiset sulamis-/kiehumispisteet. Ne voivat olla kolmessa aggregaatiotilassa: nestemäinen, kiinteä, kaasumainen. Tähän ryhmään kuuluvat useimmat ei-metallien yksinkertaiset aineet sekä niiden yhdisteet keskenään. Molekyyliaineiden atomien väliset sidokset ovat kovalenttisia.
Ei-molekyylisillä aineilla on korkea sulamis-/kiehumispiste. Ne ovat kiinteässä tilassa. Nämä, kuten arvasit, ovat yksinkertaisia metalliaineita, niiden yhdisteitä ei-metallien kanssa, ei-metalleja ovat boori, hiili-timantti, fosfori (musta ja punainen), pii. Ei-molekyyliset aineet muodostavat ionisia, atomi- ja molekyylikiteitä, joiden hiukkasten järjestyksellä on selkeä sekvenssi ja ne muodostavat hilan.
Kidehilan tyypit
Kidehiloja on neljää tyyppiä riippuen hilan solmukohdissa sijaitsevien hiukkasten tyypeistä:

1) Ioninenkidehila on ominaista yhdisteille, joilla on ionityyppinen kemiallinen sidos. Kationit ja anionit sijaitsevat hilakohdissa. Esimerkkejä aineista, joissa on tämäntyyppinen kidehila, ovat tyypillisten metallien suolat, oksidit ja hydroksidit. Nämä ovat kovia mutta hauraita aineita. Niille on ominaista tulenkestävyys. Ne liukenevat veteen ja johtavat sähköä.

2) Ydinvoima hilassa on atomeja solmuissaan. Hiukkaset muodostavat kovalenttisia ei-polaarisia ja polaarisia sidoksia. Yksinkertaisista aineista tämäntyyppinen kidehila kuuluu hiileen grafiitin ja timantin, boorin, piin ja germaniumin muodossa. Monimutkaisista aineista esimerkiksi piioksidilla (kvartsi, vuorikide) on atomihila. Nämä ovat erittäin kovia, tulenkestäviä aineita, jotka eivät ole kovin yleisiä luonnossa. Ne eivät liukene veteen.

3) Molekyyli Kidehilan muodostavat molekyylit, joita pitävät yhdessä heikot molekyylien väliset vetovoimat. Siksi tämän tyyppisille hilan aineille on ominaista alhainen kovuus, hauraus ja alhainen sulamislämpötila. Tämä on esimerkiksi jäissä olevaa vettä. Useimmilla kiinteillä orgaanisilla yhdisteillä on tällainen hila. Yhdisteen sidostyyppi on kovalenttinen.