4. Natura e tipologie dei legami chimici. Legame covalente
Applicazione. Struttura spaziale delle molecole
Ogni molecola (ad esempio CO 2, H 2 O, NH 3) o ione molecolare (ad esempio CO 3 2 −, H 3 O +, NH 4 +) ha una certa composizione qualitativa e quantitativa, nonché struttura ( geometria). Geometria della molecola si forma a causa di una disposizione relativa fissa di atomi e valori degli angoli di legame.
L'angolo di legame è l'angolo formato da linee rette immaginarie che passano attraverso i nuclei degli atomi legati chimicamente. Possiamo anche dire che è l'angolo tra due linee di legame che hanno un atomo in comune.
Una linea di legame è una linea che collega i nuclei di due atomi legati chimicamente.
Solo nel caso delle molecole biatomiche (H 2, Cl 2, ecc.) La questione della loro geometria non si pone: sono sempre lineari, cioè i nuclei degli atomi si trovano sulla stessa linea retta. La struttura di molecole più complesse può assomigliare a diverse forme geometriche, ad esempio:
- molecole triatomiche e ioni del tipo AX 2 (H 2 O, CO 2, BeCl 2)

- molecole tetraatomiche e ioni di tipo AX 3 (NH 3, BF 3, PCl 3, H 3 O +, SO 3) o A 4 (P 4, As 4)

- molecole pentaatomiche e ioni del tipo AX 4 (CH 4, XeF 4, GeCl 4)

Esistono particelle di una struttura più complessa (ottaedro, bipiramide trigonale, esagono regolare piatto). Inoltre, le molecole e gli ioni possono avere la forma di un tetraedro distorto, di un triangolo irregolare; nelle molecole a struttura angolare i valori di α possono essere diversi (90°, 109°, 120°).
La struttura delle molecole viene stabilita in modo affidabile sperimentalmente utilizzando vari metodi fisici. Per spiegare le ragioni della formazione di una particolare struttura e prevedere la geometria delle molecole, sono stati sviluppati vari modelli teorici. I più facili da comprendere sono il modello di repulsione delle coppie di elettroni di valenza (modello OVEP) e il modello di ibridazione degli orbitali atomici di valenza (modello GVAO).
La base di tutti i modelli teorici (compresi i due citati) che spiegano la struttura delle molecole è la seguente proposizione: lo stato stabile di una molecola (ione) corrisponde a una disposizione spaziale dei nuclei atomici in cui la mutua repulsione degli elettroni nella valenza lo strato è minimo.
Ciò tiene conto della repulsione degli elettroni sia partecipanti alla formazione di un legame chimico (elettroni di legame) sia di quelli che non partecipano (coppie solitarie di elettroni). Si tiene conto del fatto che l'orbitale di una coppia di elettroni di legame è concentrato in modo compatto tra due atomi e quindi occupa meno spazio dell'orbitale di una coppia di elettroni solitari. Per questo motivo, l'effetto repulsivo di una coppia di elettroni non leganti (solitari) e il suo effetto sugli angoli di legame sono più pronunciati di quelli di legame.
Modello OVEP. Questa teoria si basa sui seguenti principi fondamentali (esposti in modo semplificato):
- la geometria della molecola è determinata solo dai legami σ (ma non dai legami π);
- Gli angoli tra i legami dipendono dal numero di coppie solitarie di elettroni nell'atomo centrale.
Queste disposizioni dovrebbero essere considerate insieme, poiché sia gli elettroni di un legame chimico che le coppie solitarie di elettroni si respingono a vicenda, il che alla fine porta alla formazione di una struttura molecolare in cui questa repulsione è minima.
Consideriamo la geometria di alcune molecole e ioni dal punto di vista del metodo OVEP; gli elettroni di un legame σ saranno indicati con due punti (:), le coppie solitarie di elettroni con un simbolo convenzionale ( o ) o un trattino.
Cominciamo con la molecola a cinque atomi di metano CH 4. In questo caso, l'atomo centrale (questo carbonio) ha completamente esaurito le sue capacità di valenza e non contiene coppie solitarie di elettroni di valenza, cioè tutti e quattro gli elettroni di valenza formano quattro legami σ. Come dovrebbero essere posizionati gli elettroni del legame σ l'uno rispetto all'altro in modo che la repulsione tra loro sia minima? Ovviamente, con un angolo di 109°, cioè lungo le linee dirette ai vertici di un tetraedro immaginario, al centro del quale si trova un atomo di carbonio. In questo caso, gli elettroni che prendono parte alla formazione del legame sono quanto più distanti possibile tra loro (per una configurazione quadrata, la distanza tra questi elettroni di legame è maggiore e la repulsione interelettronica è minore). Per questo motivo la molecola del metano, così come le molecole CCl 4, CBr 4, CF 4, hanno la forma di un tetraedro regolare (dicono che abbiano una struttura tetraedrica):

Il catione ammonio NH + 4 e l'anione BF 4 − hanno la stessa struttura, poiché gli atomi di azoto e boro formano quattro legami σ ciascuno e non hanno coppie solitarie di elettroni.
Consideriamo la struttura della molecola di ammoniaca tetraatomica NH 3. La molecola di ammoniaca ha tre coppie di elettroni di legame e una coppia solitaria di elettroni sull'atomo di azoto, cioè anche quattro coppie di elettroni. Tuttavia, l’angolo di legame rimarrà a 109°? No, poiché una coppia solitaria di elettroni, occupando un volume maggiore nello spazio, ha un forte effetto repulsivo sugli elettroni del legame σ, che porta ad una leggera diminuzione dell'angolo di legame, in questo caso questo angolo è di circa 107°. La molecola di ammoniaca ha la forma di una piramide trigonale (struttura piramidale):

Anche lo ione idronio tetraatomico H 3 O + ha una struttura piramidale: l'atomo di ossigeno forma tre legami σ e contiene una coppia solitaria di elettroni.
Nella molecola BF 3 a quattro atomi, anche il numero di legami σ è tre, ma l'atomo di boro non ha coppie solitarie di elettroni. Ovviamente la repulsione interelettronica sarà minima se la molecola BF 3 ha la forma di un triangolo piatto regolare con angolo di legame di 120°:

Le molecole BCl 3, BH 3, AlH 3, AlF 3, AlCl 3, SO 3 hanno la stessa struttura e per le stesse ragioni.
Che struttura avrà una molecola d'acqua?
Una molecola d'acqua triatomica ha quattro coppie di elettroni, ma solo due di essi sono elettroni di legame σ, i restanti due sono coppie solitarie di elettroni dell'atomo di ossigeno. L’effetto repulsivo di due coppie solitarie di elettroni in una molecola di H 2 O è più forte che in una molecola di ammoniaca con una coppia solitaria, quindi l’angolo di legame H–O–H è minore dell’angolo H–N–H in una molecola di ammoniaca. : in una molecola d'acqua l'angolo di legame è di circa 105° :

Anche la molecola di CO 2 (O=C=O) ha due coppie di elettroni di legame (consideriamo solo i legami σ), tuttavia, a differenza di una molecola di acqua, l'atomo di carbonio non ha coppie solitarie di elettroni. Ovviamente, la repulsione tra coppie di elettroni in questo caso sarà minima se si trovano ad un angolo di 180°, cioè con una forma lineare della molecola di CO 2:
Le molecole BeH 2, BeF 2, BeCl 2 hanno una struttura simile e per le stesse ragioni. In una molecola triatomica di SO 2, anche l'atomo centrale (atomo di zolfo) forma due legami σ, ma ha una coppia solitaria di elettroni, quindi la molecola di ossido di zolfo (IV) ha una struttura angolare, ma l'angolo di legame in essa è maggiore di in una molecola d'acqua (l'atomo di ossigeno ha due coppie solitarie di elettroni e l'atomo di zolfo ne ha solo uno):

Alcune molecole triatomiche della composizione ABC (ad esempio H–C≡N, Br–C≡N, S=C=Te, S=C=O) hanno anche una struttura lineare, in cui l'atomo centrale non ha particelle solitarie coppie di elettroni. Ma la molecola di HClO ha una struttura angolare (α ≈ 103°), poiché l'atomo centrale, l'atomo di ossigeno, contiene due coppie solitarie di elettroni.
Utilizzando il modello OVEP è inoltre possibile prevedere la struttura delle molecole delle sostanze organiche. Ad esempio, nella molecola dell'acetilene C 2 H 2, ciascun atomo di carbonio forma due legami σ e gli atomi di carbonio non hanno coppie solitarie di elettroni; pertanto, la molecola ha una struttura lineare H–C≡C–H.
Nella molecola di etene C 2 H 4, ciascun atomo di carbonio forma tre legami σ, che, in assenza di coppie solitarie di elettroni sugli atomi di carbonio, portano ad una disposizione triangolare di atomi attorno a ciascun atomo di carbonio:
Nella tabella 4.2 riassume alcuni dati sulla struttura delle molecole e degli ioni.
Tabella 4.2
Relazione tra la struttura delle molecole (ioni) e il numero σ -legami e coppie solitarie di elettroni dell'atomo centrale
| Tipo di molecola (ione) | Numero di legami σ formati dall'atomo centrale | Numero di coppie solitarie di elettroni | Struttura, angolo di legame | Esempi di particelle (atomo centrale evidenziato) |
|---|---|---|---|---|
| AB2 | 2 | 0 | Lineare, α = 180° | CO 2 , Be H 2 , HC N , Be Cl 2 , C 2 H 2 , N 2 O , C S 2 |
| 1 | Angolare, 90°< α < 120° | Sn Cl 2, S O 2, N O 2 − | ||
| 2 | Angolare, α< 109° | H 2 O , OF 2 , H 2 S , H 2 Se , S F 2 , Xe O 2 , - | ||
| AB3 | 3 | 0 | Triangolare, α ≈ 120° | B F 3, B H 3, B Cl 3, Al F 3, S O 3, C O 3 2 −, N O 3 − |
| 1 | Piramide trigonale, α< 109° | N H 3 , H 3 O + , N F 3 , S O 3 2 - , PF 3 , P Cl 3 , Come H 3 | ||
| AB4 | 4 | 0 | Tetraedro, α = 109° | N H 4 + , CH 4 , Si H 4 , B F 4 , BH 4 - , S O 4 2 - , UN l H 4 - |
Modello GVAO. La posizione principale di questo modello è che la formazione di legami covalenti non coinvolge gli orbitali “puri” di valenza s, p e d, ma i cosiddetti orbitali orbitali ibridi. Successivamente, viene considerata l'ibridazione che coinvolge solo 2p- e 2s-AO.
L'ibridazione è il fenomeno della mescolanza degli orbitali di valenza, a seguito della quale si allineano in forma ed energia.
Il concetto di ibridazione viene sempre utilizzato quando elettroni di diversi sottolivelli energetici che non differiscono molto in energia partecipano alla formazione di legami chimici: 2s e 2p, 4s, 4p e 3d, ecc.
L'orbitale ibrido non ha una forma simile agli originali 2p- e 2s-AO. Ha la forma di un otto tridimensionale irregolare:
Come possiamo vedere, gli AO ibridi sono più allungati, quindi possono sovrapporsi meglio e formare legami covalenti più forti. Quando gli orbitali ibridi si sovrappongono, si formano solo legami σ; A causa della loro forma specifica, gli AO ibridi non partecipano alla formazione di legami π (solo gli AO non ibridi formano legami π). Il numero di orbitali ibridi è sempre uguale al numero di AO iniziali che partecipano all'ibridazione. Gli orbitali ibridi devono essere orientati nello spazio in modo tale da garantire la massima distanza l'uno dall'altro. In questo caso, la repulsione degli elettroni su di essi (legame e non legame) sarà minima; anche l'energia dell'intera molecola sarà minima.
Il modello GVAO presuppone che l'ibridazione coinvolga orbitali con valori energetici simili (cioè orbitali di valenza) e una densità elettronica sufficientemente elevata. La densità elettronica di un orbitale diminuisce all'aumentare delle sue dimensioni, quindi il ruolo nell'ibridazione è particolarmente significativo per le molecole di elementi di piccoli periodi.
Va ricordato che il GAO non è un fenomeno fisico reale, ma un concetto conveniente (modello matematico) che permette di descrivere la struttura di alcune molecole. La formazione di AO ibridi non viene rilevata con alcun metodo fisico. Tuttavia, la teoria dell'ibridazione ha qualche giustificazione fisica.
Consideriamo la struttura della molecola di metano. È noto che la molecola CH4 ha la forma di un tetraedro regolare con un atomo di carbonio al centro tutti e quattro i legami C–H sono formati da un meccanismo di scambio e hanno la stessa energia e lunghezza, cioè sono equivalenti. È abbastanza semplice spiegare la presenza di quattro elettroni spaiati in un atomo di carbonio, assumendo la sua transizione allo stato eccitato:

Tuttavia, questo processo non spiega in alcun modo l'equivalenza di tutti e quattro i legami C–H, poiché secondo lo schema sopra tre di essi si formano con la partecipazione del 2p-AO dell'atomo di carbonio, uno con la partecipazione di il 2s-AO e la forma e l'energia di 2p e 2s-AO sono diverse.
Per spiegare questo e altri fatti simili, L. Pauling ha sviluppato il concetto di GVAO. Si presume che la miscelazione degli orbitali avvenga al momento della formazione dei legami chimici. Questo processo richiede un dispendio energetico per l’accoppiamento degli elettroni, che, tuttavia, è compensato dal rilascio di energia quando gli AO ibridi formano legami più forti (rispetto ai non ibridi).
In base alla natura e al numero di AO coinvolti nell'ibridazione, si distinguono diversi tipi.
Nel caso dell'ibridazione sp 3, gli orbitali uno e tre p vengono mescolati (da cui il nome del tipo di ibridazione). Per un atomo di carbonio, il processo può essere rappresentato come segue:
1 s 2 2 s 2 2 p x 1 2 p y 1 → transizione elettronica 1 s 2 2 s 1 2 p x 1 2 p y 1 2 p z 1 → ibridazione 1 s 2 2 (s p 3) 4
oppure utilizzando configurazioni elettroniche:

Quattro AO ibridi sp 3 occupano una posizione intermedia in energia tra gli AO 2p e 2s.
Lo schema di ibridazione sp 3 può essere rappresentato utilizzando immagini della forma AO dell'atomo di carbonio:

Pertanto, come risultato dell'ibridazione sp 3, si formano quattro orbitali ibridi, ciascuno dei quali contiene un elettrone spaiato. Questi orbitali si trovano ad un angolo di 109°28′ nello spazio, il che garantisce una repulsione minima degli elettroni che si trovano su di essi. Se colleghi i vertici degli orbitali ibridi, otterrai una figura tridimensionale: un tetraedro. Per questo motivo, le molecole della composizione AX 4 (CH 4, SiH 4, CCl 4, ecc.), in cui si realizza questo tipo di ibridazione, hanno la forma di un tetraedro.
Il concetto di ibridazione sp 3 dell'AO spiega bene anche la struttura delle molecole di H 2 O e NH 3. Si presume che 2s - e 2p -AO di atomi di azoto e ossigeno partecipino all'ibridazione. In questi atomi, il numero di elettroni di valenza (5 e 6, rispettivamente) supera il numero di AO ibridi sp 3 (4), pertanto alcuni AO ibridi contengono elettroni spaiati e alcuni contengono coppie solitarie di elettroni:

Vediamo che nell'atomo di azoto la coppia solitaria di elettroni si trova su un AO ibrido e nell'atomo di ossigeno su due. Solo gli AO con elettroni spaiati partecipano alla formazione di legami con atomi di idrogeno e le coppie solitarie di elettroni avranno un effetto repulsivo (Fig. 4.5) l'uno sull'altro (nel caso dell'ossigeno) e sugli elettroni di legame (per ossigeno e azoto ).

Riso. 4.5. Schema dell'azione repulsiva degli orbitali leganti e non leganti nella molecola di ammoniaca (a) e acqua (b)
La repulsione è più forte nel caso della molecola d'acqua. Poiché l’atomo di ossigeno ha due coppie solitarie di elettroni, la deviazione dall’angolo di legame ideale per questo tipo di ibridazione (109°28′) in una molecola di acqua è maggiore che in una molecola di ammoniaca (nelle molecole di H2O e NH3 l’angolo di legame è 104, rispettivamente ,5° e 107°).
Il modello di ibridazione sp 3 viene utilizzato per spiegare la struttura del diamante, del silicio, degli ioni NH 4 + e H 3 O +, degli alcani, dei cicloalcani, ecc. Nel caso del carbonio, questo tipo di ibridazione viene sempre utilizzato quando un atomo di questo l'elemento forma solo legami σ.
Nel caso dell'ibridazione sp 2, gli orbitali uno e due p vengono mescolati. Consideriamo questo tipo di ibridazione usando l'esempio di un atomo di boro. Il processo è rappresentato utilizzando diagrammi energetici


Pertanto, come risultato dell'ibridazione sp 2 degli orbitali di valenza dell'atomo di boro, si formano tre AO ibridi, diretti con un angolo di 120°, e uno degli orbitali 2p non prende parte all'ibridazione. Gli orbitali ibridi contengono un elettrone spaiato, si trovano sullo stesso piano e se colleghi i loro vertici, otterrai un triangolo regolare. Per questo motivo le molecole della composizione AX 3 con ibridazione sp 2 degli orbitali dell'atomo A hanno una struttura triangolare, come mostrato per la molecola BF 3:

Il 2p-AO non ibrido dell'atomo di boro è libero (non occupato) e orientato perpendicolarmente al piano dei legami B–F, quindi la molecola BF 3 è un accettore di elettroni quando forma un legame covalente secondo il meccanismo donatore-accettore quando interagendo con una molecola di ammoniaca.
Il concetto di ibridazione sp 2 viene utilizzato per spiegare la natura del doppio legame carbonio-carbonio negli alcheni, la struttura del benzene e della grafite, ad es. nei casi in cui l'atomo di carbonio forma tre legami σ e un legame π.
La disposizione spaziale degli orbitali dell'atomo di carbonio per l'ibridazione sp 2 si presenta così: l'AO 2p non ibrido è orientato perpendicolare al piano in cui si trovano gli orbitali ibridi (sia l'AO ibrido che quello non ibrido contengono un elettrone spaiato) .

Consideriamo la formazione di legami chimici nella molecola di etilene H 2 C=CH 2. In esso, gli AO ibridi si sovrappongono tra loro e con gli 1s-AO dell'atomo di idrogeno, formando cinque legami σ: uno C–C e quattro C–H. I 2p-AO non ibridi si sovrappongono lateralmente e formano un legame π tra gli atomi di carbonio (Fig. 4.6).

Riso. 4.6. Schema di formazione dei legami σ (a) e del legame π (b) in una molecola di etilene
Nel caso dell'ibridazione sp, gli orbitali uno e uno p vengono mescolati. Consideriamo questo tipo di ibridazione usando l'esempio dell'atomo di berillio. Immaginiamo il processo di ibridazione utilizzando un diagramma energetico:

e con un'immagine della forma degli orbitali
Pertanto, come risultato dell'ibridazione sp, si formano due AO ibridi, ciascuno contenente un elettrone spaiato. Due 2p-AO non prendono parte all'ibridazione e, nel caso del berillio, rimangono vacanti. Gli orbitali ibridi sono orientati con un angolo di 180°, quindi le molecole del tipo AX 2 con ibridazione sp degli orbitali dell'atomo A hanno una struttura lineare (Fig. 4.7).

Riso. 4.7. Struttura spaziale della molecola BeCl 2
Utilizzando il modello di ibridazione sp degli orbitali dell'atomo di carbonio, viene spiegata la natura del triplo legame nelle molecole di alchini. In questo caso, due 2p-AO ibridi e due non ibridi (mostrati dalle frecce orizzontali →, ←) contengono ciascuno un elettrone spaiato:

Nella molecola di acetilene HC≡CH, a causa degli AO ibridi, si formano legami σ C–H e C–C:

I 2p-AO ibridi si sovrappongono su due piani perpendicolari e formano due legami π tra gli atomi di carbonio (Fig. 4.8).

Riso. 4.8. Rappresentazione schematica dei legami π (a) e dei piani dei legami π (b) nella molecola di acetilene (la linea ondulata mostra la sovrapposizione laterale del 2p-AO dell'atomo di carbonio)
Il concetto di ibridazione sp degli orbitali dell'atomo di carbonio consente di spiegare la formazione di legami chimici nelle molecole di carbina, CO e CO 2, propadiene (CH 2 =C=CH 2), cioè in tutti i casi in cui un atomo di carbonio forma due legami σ e due legami π.
Le principali caratteristiche dei tipi di ibridazione considerati e le configurazioni geometriche delle molecole corrispondenti ad alcuni tipi di ibridazione degli orbitali dell'atomo centrale A (tenendo conto dell'influenza delle coppie di elettroni non leganti) sono presentate nella Tabella. 4.3 e 4.4.
Tabella 4.3
Principali caratteristiche dei diversi tipi di ibridazione
Confrontando i dati della tabella. 4.2 e 4.4, possiamo concludere che entrambi i modelli - OVEP e GVAO - portano agli stessi risultati per quanto riguarda la struttura delle molecole.
Tabella 4.4
Tipi di configurazione spaziale delle molecole corrispondenti a determinati tipi di ibridazione
opzione 2
Parte A:
UN 1. Una coppia di elementi tra i quali si forma un legame chimico ionico:
a) carbonio e zolfo, b) idrogeno e azoto, c) potassio e ossigeno, d) silicio e idrogeno.
UN 2.Formula di una sostanza con un legame covalente:
a) NaCl, b) HCl, c) BaO, d) Ca 3 N 2.
UN 3.Il legame meno polare è:
a) C – H, b) C – Cl, c) C – F, d) C – Br.
UN 4. L’affermazione che δ è un legame, a differenza di π, è vera:
a) meno durevole, b) formato quando gli orbitali atomici si sovrappongono lateralmente,
c) non è covalente, d) è formato dalla sovrapposizione assiale degli orbitali atomici.
UN 5.Una sostanza nella cui molecola non è presente alcun legame π:
a) etilene, b) benzene, c) ammoniaca, d) azoto.
UN 6. La molecola più forte è:
a) H 2, b) N 2, c) F 2, d) O 2.
Un 7. Nello ione CO 3 2-, l'atomo di carbonio è nello stato ibrido sp 2 -, quindi lo ione ha la forma:
a) lineare, b) tetraedro, c) triangolo, d) ottaedro.
UN 8. Un atomo di carbonio ha un numero di ossidazione pari a -3 e una valenza pari a 4 se combinato con la formula:
a) CO 2, b) C 2 H 6, c) CH 3 Cl, d) CaC 2.
A 9. Il reticolo cristallino atomico ha:
a) soda, b) acqua, c) diamante, d) paraffina.
Un 10. Una sostanza tra molecole di cui esiste un legame idrogeno:
a) etano, b) fluoruro di sodio, c) monossido di carbonio (4), d) etanolo.
UN 11. Seleziona un gruppo di elementi disposti in ordine di elettronegatività crescente:
a) Cl, Si, N, O, b) Si, P, N, F, c) F, Cl, O, Si, d) O, N, F, Cl.
UN 12. Esiste un legame covalente tra gli atomi, formato da un meccanismo donatore-accettore in una sostanza, la cui formula è:
13.
UN 14.La formazione dei legami idrogeno può essere spiegata da:
a) solubilità dell'acido acetico in acqua, b) proprietà acide dell'etanolo,
c) alto punto di fusione di molti metalli, d) insolubilità del metano in acqua.
Un 15.Formula di una sostanza con un legame covalente polare:
a) Cl 2, b) KCl, c) NH 3, d) O 2.
Parte B:
B1. Tra quelle proposte, seleziona una sostanza la cui molecola contiene legami π: H 2, CH 4, Br 2, N 2, H 2 S, CH 3 OH, NH 3. Scrivi il nome di questa sostanza.
B2. Il processo di interazione degli orbitali elettronici, che porta al loro allineamento in forma ed energia, è chiamato......
B3. Qual è il nome del fenomeno dell'ingrandimento delle particelle colloidali e della loro precipitazione da una soluzione colloidale?
B4. Fornisci un esempio di una sostanza la cui molecola contiene tre legami δ e uno π. Nominare la sostanza al caso nominativo.
B5. In quale delle seguenti sostanze sono i legami più polari: acido cloridrico, fluoro, acqua, ammoniaca, idrogeno solforato. Annotare la sostanza selezionata con una formula.
Parte C:
Dall'1. Scrivi le formule strutturali di tutte le sostanze isomeriche della composizione C 4 H 8. Assegna un nome a ciascuna sostanza.
C2. Componi le formule di struttura delle sostanze: CHF 3, C 2 H 2 Br 2, O 2.
Formule grafiche di composizione: Mg 3 N 2, Na 2 SO 4, KHCO 3.
C3.
Mg 3 N 2, Cl 2, ZnSO 4, KHS, CH 3 Cl, FeOHCl 2, BrO 2, AsO 4 3-, NH 4 +
Prova n.2 “STRUTTURA DELLA MATERIA”.
Opzione 3
Parte A:
UN 1. Legami chimici in sostanze le cui formule sono rispettivamente CH 4 e CaCl 2:
a) ionico e covalente polare, b) covalente polare e ionico,
c) covalente non polare e ionico, d) covalente polare e metallico.
UN 2.La polarità del legame è maggiore nella sostanza con la formula:
a) Br2, b) LiBr, c) HBr, d) KBr
UN 3.La natura ionica del legame nella serie di composti Li 2 O - Na 2 O - K 2 O - Rb 2 O:
a) aumenta, b) diminuisce, c) non cambia, d) prima diminuisce, poi aumenta.
UN 4. Esiste un legame covalente tra gli atomi, formato da un meccanismo donatore-accettore in una sostanza, la cui formula è:
a) Al(OH) 3, b) [CH 3 NH 3 ]Cl, c) C 2 H 5 OH, d) C 6 H 12 O 6.
UN 5.Un paio di formule per sostanze le cui molecole contengono solo legami δ:
a) CH 4 e O 2, b) C 2 H 5 OH e H 2 O, c) N 2 e CO 2, d) HBr e C 2 H 4.
UN 6. La connessione più forte tra questi:
a) C - Cl, b) C - F, c) C - Br, d) C - I.
Un 7. Un gruppo di formule di composti in cui esiste una direzione simile dei legami, dovuta all'ibridazione sp 3 degli orbitali elettronici:
a) CH 4, C 2 H 4, C 2 H 2, b) NH 3, CH 4, H 2 O, c) H 2 O, C 2 H 6, C 6 H 6, d) C 3 H 8, BCl3, BeCl2.
UN 8. La valenza e lo stato di ossidazione dell'atomo di carbonio nella molecola di metanolo sono rispettivamente pari a:
a) 4 e +4, b) 4 e -2, c) 3 e +2, d) 4 e -3.
A 9. Le sostanze con reticolo cristallino ionico sono caratterizzate da:
a) scarsa solubilità in acqua, b) alto punto di ebollizione, c) fusibilità, d) volatilità.
Un 10. La formazione di un legame idrogeno tra le molecole porta a:
a) ridurre i punti di ebollizione delle sostanze, b) ridurre la solubilità delle sostanze in acqua,
c) ad un aumento dei punti di ebollizione delle sostanze, d) ad un aumento della volatilità delle sostanze.
UN 11. Formula di una sostanza con un legame ionico:
a) NH 3, b) C 2 H 4, c) KH, d) CCl 4.
UN 12. Nella molecola è presente solo il legame δ:
a) azoto, b) etanolo, c) etilene, d) monossido di carbonio (4).
13. La struttura molecolare ha una sostanza con la formula:
a) CH4, b) NaOH, c) SiO2, d) Al.
UN 14.Si forma un legame idrogeno tra:
a) molecole d'acqua, b) molecole di idrogeno,
c) molecole di idrocarburi, d) atomi di metalli e atomi di idrogeno.
Un 15.Se agiti vigorosamente la miscela di olio vegetale e acqua, ottieni:
a) sospensione, b) emulsione, c) schiuma, d) aerosol.
Parte B:
B1. Il numero di coppie di elettroni comuni tra gli atomi di bromo in una molecola di Br 2 è……
B2. Quali legami formano il triplo legame nella molecola N 2 (presentare la risposta al caso nominativo).
B3. Ai nodi del reticolo cristallino metallico ci sono…….. .
B4. Fornisci un esempio di una sostanza la cui molecola contiene cinque legami δ e due legami π. Nominare la sostanza al caso nominativo.
B5. Qual è il numero massimo di legami π che possono formarsi tra due atomi in una molecola? (rappresentare la risposta come un numero)
Parte C:
Dall'1. Scrivi le formule strutturali di tutte le sostanze isomeriche della composizione C 5 H 10 O. Assegna un nome a ciascuna sostanza.
C2. Componi le formule di struttura delle sostanze: CHCl 3, C 2 H 2 Cl 2, F 2.
Formule grafiche di composizione: AlN, CaSO 4, LiHCO 3.
C3. Determinare il grado di ossidazione nei composti chimici e negli ioni:
HNO 3, HClO 4, K 2 SO 3, KMnO 4, CH 3 F, MgOHCl 2, ClO 3 -, CrO 4 2-, NH 4 +
Informazioni correlate.
La struttura chimica è la sequenza delle combinazioni di atomi in una molecola e la loro disposizione nello spazio. La struttura chimica è rappresentata utilizzando formule strutturali. Il trattino rappresenta un legame chimico covalente. Se la connessione è multipla: doppia, tripla, poi metti due (da non confondere con il segno “uguale”) o tre trattini. Gli angoli tra i legami sono rappresentati quando possibile.
Per comporre correttamente le formule strutturali delle sostanze organiche è necessario ricordare che gli atomi di carbonio formano 4 legami
(cioè la valenza del carbonio in base al numero di legami è pari a quattro. In chimica organica è la valenza in base al numero di legami ad essere utilizzata prevalentemente).
Metano(chiamato anche gas di palude) è costituito da un atomo di carbonio legato da legami covalenti a quattro atomi di idrogeno. Formula molecolare CH4. Formula strutturale:
H
l
H–C–H
l
H
L'angolo tra i legami nella molecola di metano è di circa 109° - le coppie di elettroni che formano legami covalenti dell'atomo di carbonio (al centro) con gli atomi di idrogeno si trovano nello spazio alla massima distanza l'uno dall'altro.
Nelle classi 10-11, si studia che la molecola di metano ha la forma di una piramide triangolare - un tetraedro, come le famose piramidi egiziane.
Etilene C 2 H 4 contiene due atomi di carbonio collegati da un doppio legame:
L'angolo tra i legami è di 120° (le coppie di elettroni si respingono e si trovano alla massima distanza l'una dall'altra). Gli atomi si trovano sullo stesso piano.
Se non rappresentiamo ciascun atomo di idrogeno separatamente, otteniamo la formula strutturale abbreviata:
Acetilene C 2 H 2 contiene un triplo legame:
H – C ≡ C – H
L'angolo tra i legami è di 180°, la molecola ha una forma lineare.
Quando brucia gli idrocarburi formano ossidi di carbonio (IV) e idrogeno, cioè anidride carbonica e acqua, e viene rilasciato molto calore:
CH4 + 2O2 → CO2 + 2H2O
C2H4 + 3O2 → 2CO2 + 2H2O
2C 2 H 2 + 5O 2 → 4CO 2 + 2H 2 O (nell'equazione con l'acetilene, mettiamo il coefficiente 2 prima della formula dell'acetilene in modo che il numero di atomi di ossigeno sul lato destro sia pari)
Di grande importanza pratica reazione di polimerizzazione etilene - la combinazione di un gran numero di molecole per formare macromolecole polimeriche - polietilene. I legami tra le molecole si formano rompendo uno dei legami di un doppio legame. In generale si può scrivere così:
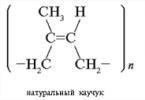
nCH 2 = CH 2 → (- CH 2 – CH 2 -) n
dove n è il numero di molecole collegate, chiamato grado di polimerizzazione. La reazione avviene a pressione e temperatura elevate, in presenza di un catalizzatore.
Le pellicole per serre, le coperture per lattine, ecc. sono realizzate in polietilene.
Anche la formazione di benzene dall'acetilene è classificata come reazione di polimerizzazione.
Esame di Stato Unificato. Struttura della materia (tipologie di legami chimici, tipologie di reticoli cristallini, stato di ossidazione)
Tipi di legame chimico
La lezione è dedicata alla risoluzione dei problemi dell'Esame di Stato Unificato sull'argomento "Struttura della materia (tipi di legami chimici, tipi di reticoli cristallini, stati di ossidazione)". Obiettivi della lezione: imparare a confrontare le tipologie dei reticoli cristallini con le proprietà della materia. In base al tipo di legame chimico, prevedere i tipi di reticolo cristallino di una sostanza. Verifica la tua comprensione dei concetti: numero di ossidazione e valenza.
|
Domanda |
Un commento |
|
A1. Le sostanze complesse si chiamano: 1. composti formati da sostanze diverse 2. composti formati da diversi elementi chimici 3. composti a composizione costante 4. composti a composizione variabile |
Una sostanza semplice è un composto formato da atomi di un elemento chimico, mentre una sostanza complessa è formata da atomi di diversi elementi chimici. Risposta corretta 2. |
|
A2. La sostanza la cui formula ha il punto di fusione più alto è: |
Devi sapere quali reticoli cristallini hanno queste sostanze: CH 4 - molecolare, SiO 2 - atomico, Sn - metallico, KF - ionico Le sostanze con un reticolo cristallino atomico sono caratterizzate dal punto di fusione più alto. Risposta corretta 2. |
|
A3. Le sostanze di struttura molecolare sono tutte le sostanze della serie: 1. zolfo, sale da cucina, zucchero 2. zucchero, sale da cucina, glicina 3. zucchero, glicina, solfato di rame 4. zolfo, glicerina, zucchero |
Zolfo, zucchero, glicina, glicerina sono sostanze di struttura molecolare. Il sale da cucina e il solfato di rame hanno un reticolo cristallino ionico. Queste sono sostanze di struttura non molecolare. La risposta corretta è 4. |
|
A4. Le sostanze di struttura molecolare includono: 2. C6H12O6 4. C2H5ONa |
Analizziamo: a che tipo di reticoli cristallini appartengono queste sostanze? CaO, KF, C 2 H 5 ONa hanno un reticolo cristallino ionico. C 6 H 12 O 6 - molecolare. Risposta corretta 2. |
|
A5. Delle sostanze elencate, la struttura non molecolare ha: |
Se una sostanza contiene più atomi (I 2), allora è una sostanza con struttura molecolare. Risposta corretta 3. |
|
A6. Legame chimico nel bromuro di potassio: 1. covalente non polare 2. polare covalente 3. metallo |
Il bromuro di potassio (KBr) è un tipico sale formato da atomi che differiscono nettamente in elettronegatività. Il legame è ionico. La risposta corretta è 4. |
|
A7. Quale legame si verifica tra gli atomi degli elementi chimici con i numeri di serie 8 e 16? 2. polare covalente 3. covalente non polare 4. idrogeno |
Questi sono S e O. Questi sono non metalli. La loro elettronegatività è vicina. Ciò significa che il legame covalente è polare. Risposta corretta 2. |
|
A8. Legame in un composto formato tra un atomo di idrogeno e un elemento avente una configurazione elettronica2 , 8 , 6 È: 2. polare covalente 3. covalente non polare 4. metallo |
Troviamo un elemento dalla distribuzione degli elettroni nell'atomo. La loro somma è uguale al numero di protoni, il numero atomico. Questo è il numero 1 - S. Formano tra loro H 2 S. Entrambi sono non metalli, con una leggera differenza di elettronegatività. Risposta corretta 2. |
|
A9. Nei composti covalenti dell'idrogeno della composizione NE, il numero di coppie di elettroni comuni è uguale a: |
Un atomo di idrogeno ha un solo elettrone, quindi quando interagisce con altri atomi può formare solo una coppia di elettroni condivisa. Risposta corretta 1. |
|
A10. Si forma uno dei legami nello ione ammonio: 1. tramite meccanismo donatore-accettore 2. attrazione elettrostatica degli ioni di azoto e idrogeno 3. socializzazione degli ioni di azoto e idrogeno 4. a causa dello scambio di elettroni |
Nello ione ammonio ci sono 4 legami covalenti. Tre di essi sono formati da un meccanismo di scambio, uno da un meccanismo donatore-accettore. Risposta corretta 1. |
|
A11. Stato di ossidazione del fosforo nel compostoH 3 P.O. 4 è uguale a: |
La somma degli stati di ossidazione, tenendo conto del numero di atomi, dovrebbe essere pari a 0. H +, O -2, quindi P +5. La risposta corretta è 4. |
|
A 12. Un atomo dell'elemento ha uno stato di ossidazione costante: |
Poiché gli elementi del gruppo IA hanno un elettrone di valenza, possono mostrare solo uno stato di ossidazione +1. La risposta corretta è 4. |
|
A13. Reticolo cristallino di grafite: 1. atomico 2. molecolare 4. metallo |
La grafite è formata da carbonio, un non metallo. Ciò significa che il reticolo cristallino non può essere ionico, metallico o molecolare. Risposta corretta 1. |
|
A14. Ai nodi dei reticoli cristallini delle sostanze di struttura molecolare si trovano: 1. Molecole 3. Atomi e ioni 4. Molecole e ioni |
Le molecole si trovano ai nodi dei reticoli cristallini di sostanze con una struttura molecolare. Risposta corretta 1. |
|
A15. Delle seguenti sostanze, quanto segue ha un reticolo cristallino atomico: 3. Naftalene |
Il magnesio è un metallo. Ha un reticolo cristallino metallico. Zolfo, naftalene - reticolo cristallino molecolare. La risposta corretta è 4. |
|
A16. Per le sostanze con un reticolo cristallino metallico, una proprietà insolita è: 1. Conduttività elettrica 2. Conduttività termica 3. Fragilità 4. Plasticità |
I metalli sono caratterizzati dalle seguenti proprietà: conduttività elettrica e termica, duttilità, lucentezza metallica. La fragilità è la proprietà opposta della duttilità, il che significa che i metalli non possono averla. Risposta corretta 3. |

La lezione riguardava la risoluzione dei problemi dell'Esame di Stato Unificato sull'argomento "Struttura della materia (tipi di legami chimici, tipi di reticoli cristallini, stati di ossidazione)". Abbiamo imparato a confrontare i tipi di reticoli cristallini con le proprietà della materia. In base al tipo di legame chimico, prevedere i tipi di reticolo cristallino di una sostanza. È stata verificata la comprensione dei concetti: stato di ossidazione e valenza.
Bibliografia
- Rudzitis G.E. Chimica. Fondamenti di chimica generale. 11° grado: libro di testo per istituti di istruzione generale: livello base / G. E. Rudzitis, F.G. Feldmann. - 14a edizione. - M.: Educazione, 2012.
- Popel P.P. Chimica: 11a elementare: libro di testo per istituti di istruzione generale / P.P. Popel, L.S. Krivlya. - K.: IC "Academy", 2008. - 240 pp.: ill.
- Materiali didattici e formativi per la preparazione all'esame di stato unificato. Chimica/Kaverina A.A., Dobrotin D.Yu., Medvedev Yu.N., Koroshchenko A.S. - M.: Centro-Intelletto, 2011.
- Interneturok.ru ().
- Ege.edu.ru ().
- Chemport.ru ().
- Khimik.ru ().
Compiti a casa
- N. 11-33 (pag. 23) Rudzitis G.E. Chimica. Fondamenti di chimica generale. 11° grado: libro di testo per istituti di istruzione generale: livello base / G. E. Rudzitis, F.G. Feldmann. - 14a edizione. - M.: Educazione, 2012.
- Con l'ossidazione completa di 2 g di una sostanza semplice, si formano 18 g di un ossido della composizione E 2 O Trova la massa molare della sostanza semplice.
- Determinare la valenza e il grado di ossidazione del carbonio nei composti: C 2 H 5 OH, CH 3 COOH.
Test n. 2 DKR “STRUTTURA DELLA SOSTANZA”.
UN 1. Legami chimici in sostanze le cui formule sono rispettivamente CH 4 e CaCl 2:
a) ionico e covalente polare, b) covalente polare e ionico,
c) covalente non polare e ionico, d) covalente polare e metallico.
UN 2. La polarità del legame è maggiore nella sostanza con la formula:
a) Br2, b) LiBr, c) HBr, d) KBr
UN 3. La natura ionica del legame nella serie di composti Li 2 O - Na 2 O - K 2 O - Rb 2 O:
a) aumenta, b) diminuisce, c) non cambia, d) prima diminuisce, poi aumenta.
UN 4. Esiste un legame covalente tra gli atomi, formato da un meccanismo donatore-accettore in una sostanza, la cui formula è:
a) Al(OH) 3, b) [CH 3 NH 3 ]Cl, c) C 2 H 5 OH, d) C 6 H 12 O 6.
UN 5. Un paio di formule per sostanze le cui molecole contengono solo legami δ:
a) CH 4 e O 2, b) C 2 H 5 OH e H 2 O, c) N 2 e CO 2, d) HBr e C 2 H 4.
UN 6. La connessione più forte tra questi:
a) C - Cl, b) C - F, c) C - Br, d) C - I.
Un 7. Un gruppo di formule di composti in cui esiste una direzione simile dei legami, dovuta all'ibridazione sp 3 degli orbitali elettronici:
a) CH 4, C 2 H 4, C 2 H 2, b) NH 3, CH 4, H 2 O, c) H 2 O, C 2 H 6, C 6 H 6, d) C 3 H 8, BCl3, BeCl2.
UN 8. La valenza e lo stato di ossidazione dell'atomo di carbonio nella molecola di metanolo sono rispettivamente pari a:
a) 4 e +4, b) 4 e -2, c) 3 e +2, d) 4 e -3.
A 9. Le sostanze con reticolo cristallino ionico sono caratterizzate da:
a) scarsa solubilità in acqua, b) alto punto di ebollizione, c) fusibilità, d) volatilità.
Un 10. La formazione di un legame idrogeno tra le molecole porta a:
a) ridurre i punti di ebollizione delle sostanze, b) ridurre la solubilità delle sostanze in acqua,
c) ad un aumento dei punti di ebollizione delle sostanze, d) ad un aumento della volatilità delle sostanze.
UN 11. Formula di una sostanza con un legame ionico:
a) NH 3, b) C 2 H 4, c) KH, d) CCl 4.
UN 12
A13. La struttura molecolare ha una sostanza con la formula:
UN 14. Si forma un legame idrogeno tra:
a) molecole d'acqua, b) molecole di idrogeno,
c) molecole di idrocarburi, d) atomi di metalli e atomi di idrogeno.
Un 15. Se agiti vigorosamente la miscela di olio vegetale e acqua, ottieni:
a) sospensione, b) emulsione, c) schiuma, d) aerosol.
A 16. Formula di una sostanza con un legame covalente polare:
a) Cl 2, b) KCl, c) NH 3, d) O 2.
A 17. Una sostanza tra le cui molecole esiste un legame idrogeno:
a) etanolo, b) metano, c) idrogeno, d) benzene.
A 18. Numero di coppie di elettroni condivise in una molecola di idrogeno:
a) uno, b) due, c) tre, d) quattro.
A 19. La polarità di un legame chimico aumenta in un numero di composti le cui formule sono:
a) NH 3, HI, O 2, b) CH 4, H 2 O, HF, c) PH 3, H 2 S, H 2, d) HCl, CH 4, CL 2.
Un 20. Reticolo cristallino del cloruro di sodio:
a) atomico, b) ionico, c) metallico, d) molecolare.
A 21. Numero di legami δ e π in una molecola di acetilene:
a) 5 δ e π - no, b) 2 δ e 3 π, c) 3 δ e 2 π, d) 4 δ e 1 π.
A 22. Le sostanze le cui formule sono: CH 3 – CH 2 – OH e CH 3 – O – CH 3 sono:
a) omologhi, b) isomeri, c) la stessa sostanza, d) sia omologhi che isomeri.
A 23. L’omologo di una sostanza la cui formula è CH 2 = CH – CH 3 è:
a) butano, b) butine - 1, c) butene - 2, d) butine - 1.
A 24. Un legame covalente non polare si forma tra gli atomi:
a) idrogeno e ossigeno, b) carbonio e idrogeno, c) cloro, d) magnesio.
Un 25. Nella molecola è presente solo il legame δ:
a) azoto, b) etanolo, c) etilene, d) monossido di carbonio (4).
A 26. L'atomo di azoto ha una valenza pari a 3 e uno stato di ossidazione pari a 0 in una molecola di una sostanza la cui formula è:
a) NH 3, b) N 2, c) CH 3 NO 2, d) N 2 O 3.
A 27. La struttura molecolare ha una sostanza con la formula:
a) CH4, b) NaOH, c) SiO2, d) Al.
A28. Il legame C–H è più forte del legame Si–H perché:
a) la lunghezza del legame è più breve, b) la lunghezza del legame è più lunga,
c) la polarità del legame è minore, d) la polarità del legame è maggiore.
A 29. Esiste un legame covalente tra gli atomi, formato da un meccanismo donatore-accettore in una sostanza, la cui formula è:
a) CH 3 NO 2, b) NH 4 NO 2, c) C 5 H 8, d) H 2 O.
Un 30. Il legame meno polare è:
a) C – H, b) C – Cl, c) C – F, d) C – Br
Parte B:
B1. Il numero di coppie di elettroni comuni tra gli atomi di bromo in una molecola di Br 2 è……
B2. Quali legami formano il triplo legame nella molecola N 2 (presentare la risposta al caso nominativo).
B3. Ai nodi del reticolo cristallino metallico ci sono…….. .
B4. Fornisci un esempio di una sostanza la cui molecola contiene cinque legami δ e due legami π. Nominare la sostanza al caso nominativo.
B5.
B6. Il numero di coppie di elettroni comuni tra gli atomi di bromo nella molecola di N 2 è……
B7. Quali legami formano il triplo legame nella molecola C 2 H 2 (presentare la risposta al caso nominativo).
B8. Ai nodi del reticolo cristallino ionico ci sono........ .
B9. Fornisci un esempio di una sostanza la cui molecola contiene cinque legami δ e un legame π. Nominare la sostanza al caso nominativo.
B10. Qual è il numero massimo di legami π che possono formarsi tra due atomi in una molecola? (rappresentare la risposta come un numero)
Parte C:
Dall'1. Scrivi le formule strutturali di tutte le sostanze isomeriche della composizione C 5 H 10 O. Assegna un nome a ciascuna sostanza.
C2 .
Componi le formule di struttura delle sostanze: CHCl 3, C 2 H 2 Cl 2, F 2.
Formule grafiche di composizione: AlN, CaSO 4, LiHCO 3.
C3.
HNO 3, HClO 4, K 2 SO 3, KMnO 4, CH 3 F, MgOHCl 2, ClO 3 -, CrO 4 2-, NH 4 +
C4. Scrivi le formule strutturali di tutte le sostanze isomeriche della composizione C 4 H 8 O 2. Assegna un nome a ciascuna sostanza.
C5 .
Componi le formule di struttura delle sostanze: CHBr 3, C 2 H 2 Br 2, Br 2.
Formule grafiche di composizione: Al 2 S 3, MgSO 4, Li 2 CO 3.
Dalle 6. Determinare il grado di ossidazione nei composti chimici e negli ioni:
CCl 4, Ba(NO 3) 2, Al 2 S 3, HClO 3, Na 2 Cr 2 O 7, K 2 O 4, SrO 2-, Cr 2 O 3 2
Pagina 1