Faceți un duș foarte fierbinte pentru o lungă perioadă de timp, oglinda de la baie devine acoperită de abur. Uiți o oală cu apă pe fereastră și apoi descoperi că apa a fiert și tigaia s-a ars. Ai putea crede că apei îi place să se schimbe de la gaz la lichid, apoi de la lichid la gaz. Dar când se întâmplă asta?
Într-un spațiu ventilat, apa se evaporă treptat la orice temperatură. Dar fierbe numai în anumite condiții. Punctul de fierbere depinde de presiunea deasupra lichidului. La presiunea atmosferică normală punctul de fierbere va fi de 100 de grade. Odată cu altitudinea, presiunea va scădea la fel ca și punctul de fierbere. În vârful Mont Blanc-ului vor fi 85 de grade și nu veți putea face ceai delicios acolo! Dar într-o oală sub presiune, când sună fluierul, temperatura apei este deja de 130 de grade, iar presiunea este de 4 ori mai mare decât presiunea atmosferică. La această temperatură, mâncarea se gătește mai repede și aromele nu scapă cu tipul pentru că robinetul este închis.
Modificări ale stării de agregare a unei substanțe cu modificări de temperatură.
Orice lichid se poate transforma în stare gazoasă dacă este suficient de încălzit, iar orice gaz se poate transforma în stare lichidă dacă este răcit. Prin urmare, butanul, care este folosit în sobele cu gaz și la țară, este depozitat în butelii închise. Este lichid și sub presiune, ca o oală sub presiune. Și în aer liber, la o temperatură puțin sub 0 grade, metanul fierbe și se evaporă foarte repede. Metanul lichefiat este stocat în rezervoare uriașe numite rezervoare. La presiunea atmosferică normală, metanul fierbe la o temperatură de 160 de grade sub zero. Pentru a preveni scăparea gazului în timpul transportului, rezervoarele sunt atinse cu grijă ca niște termosuri.
Modificări ale stărilor agregative ale unei substanțe cu modificări ale presiunii.
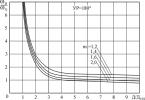
Există o dependență între stările lichide și gazoase ale unei substanțe de temperatură și presiune. Deoarece o substanță este mai saturată în stare lichidă decât în stare gazoasă, ați putea crede că dacă creșteți presiunea, gazul se va transforma imediat într-un lichid. Dar asta nu este adevărat. Cu toate acestea, dacă începeți să comprimați aerul cu o pompă de bicicletă, veți constata că se încălzește. Acumulează energia pe care o transferați apăsând pe piston. Gazul poate fi comprimat în lichid numai dacă este răcit în același timp. Dimpotrivă, lichidele trebuie să primească căldură pentru a se transforma în gaz. De aceea, evaporarea alcoolului sau eterului ia căldură din corpul nostru, creând o senzație de frig pe piele. Evaporarea apei de mare sub influența vântului răcește suprafața apei, iar transpirația răcește corpul.
Amestecuri pot diferi unele de altele nu numai în compoziţie, dar și de către aspect. După cum arată acest amestec și ce proprietăți are, acesta poate fi clasificat ca oricare omogen (omogen), sau la eterogen (eterogen) amestecuri.
Omogen (omogen) Acestea sunt amestecuri în care particulele altor substanțe nu pot fi detectate nici măcar cu un microscop.
Compoziția și proprietățile fizice în toate părțile unui astfel de amestec sunt aceleași, deoarece nu există interfețe între componentele sale individuale.
LA amestecuri omogene raporta:
- amestecuri de gaze;
- soluții;
- aliaje.
Amestecuri de gaze
Un exemplu de astfel de amestec omogen este aer.
Aerul curat conține diverse substanțe gazoase:
- azot (fracția sa de volum în aer curat este \(78\)%));
- oxigen (\(21\)%));
- gaze nobile - argon și altele (\(0,96\)%);
- dioxid de carbon (\(0,04\)%).
Amestecul gazos este gaz naturalȘi gaz petrolier asociat. Principalele componente ale acestor amestecuri sunt hidrocarburi gazoase: metan, etan, propan și butan.
De asemenea, un amestec gazos este o resursă regenerabilă, cum ar fi biogaz, format atunci când bacteriile prelucrează reziduurile organice în depozitele de gunoi, în rezervoare de tratare a apelor uzate și în instalații speciale. Componenta principală a biogazului este metan, care conține un amestec de dioxid de carbon, hidrogen sulfurat și o serie de alte substanțe gazoase.
Amestec de gaze: aer și biogaz. Aerul poate fi vândut turiștilor curioși, iar biogazul obținut din masă verde în containere speciale poate fi folosit drept combustibil
Soluții
Acesta este de obicei numele dat amestecurilor lichide de substanțe, deși acest termen în știință are un sens mai larg: o soluție este de obicei numită orice(inclusiv gazoase și solide) amestec omogen substante. Deci, despre soluțiile lichide.
O soluție importantă găsită în natură este ulei. Produse lichide obținute în timpul prelucrării sale: benzină, kerosen, motorină, păcură, uleiuri lubrifiante- sunt, de asemenea, un amestec de diferite hidrocarburi.
Fiţi atenți!
Pentru a prepara o soluție, trebuie să amestecați o substanță gazoasă, lichidă sau solidă cu un solvent (apă, alcool, acetonă etc.).
De exemplu, amoniac obţinut prin dizolvarea gazului de amoniac în intrare. La rândul său, pentru gătit tincturi de iod Iodul cristalin este dizolvat în alcool etilic (etanol).
Amestecuri lichide omogene (soluții): ulei și amoniac
Aliajul (soluția solidă) se poate obține pe bază de orice metal, iar compoziția sa poate include multe substanțe diferite.
Cele mai importante în prezent sunt aliaje de fier- fonta si otel.
Fontele sunt aliaje de fier care conțin mai mult de \(2\)% carbon, iar oțelurile sunt aliaje de fier care conțin mai puțin carbon.
Ceea ce se numește în mod obișnuit „fier” este de fapt oțel cu conținut scăzut de carbon. Cu exceptia carbon aliajele de fier pot conține siliciu, fosfor, sulf.
sisteme monofazate formate din două sau mai multe componente. După starea lor de agregare, soluțiile pot fi solide, lichide sau gazoase. Deci, aerul este o soluție gazoasă, un amestec omogen de gaze; vodcă- soluție lichidă, un amestec de mai multe substanțe care formează o fază lichidă; apa de mare- soluție lichidă, un amestec de substanțe solide (sare) și lichide (apă) formând o singură fază lichidă; alamă- soluție solidă, un amestec de două solide (cupru și zinc) formând o fază solidă. Un amestec de benzină și apă nu este o soluție deoarece aceste lichide nu se dizolvă unele în altele, rămânând ca două faze lichide cu o interfață. Componentele soluțiilor își păstrează proprietățile unice și nu intră în reacții chimice între ele pentru a forma noi compuși. Astfel, atunci când două volume de hidrogen sunt amestecate cu un volum de oxigen, se obține o soluție gazoasă. Dacă acest amestec de gaz este aprins, se formează o nouă substanță- apă, care în sine nu este o soluție. Componenta prezentă în soluție în cantități mai mari se numește de obicei solvent, restul componentelor- substanțe dizolvate.Cu toate acestea, uneori este dificil să se tragă linia dintre amestecul fizic al substanțelor și interacțiunea lor chimică. De exemplu, la amestecarea gazului clorhidric HCl cu apă
H2O Se formează ionii H 3 O+ și Cl - . Ei atrag moleculele de apă învecinate la sine, formând hidrați. Astfel, componentele inițiale sunt HCI și H 2 O - suferă modificări semnificative după amestecare. Cu toate acestea, ionizarea și hidratarea (în cazul general, solvatarea) sunt considerate procese fizice care au loc în timpul formării soluțiilor.Unul dintre cele mai importante tipuri de amestecuri care reprezintă o fază omogenă sunt soluțiile coloidale: geluri, soluri, emulsii și aerosoli. Dimensiunea particulelor în soluțiile coloidale este de 1-1000 nm, în soluții adevărate
~ 0,1 nm (de ordinul mărimii moleculare).Noțiuni de bază. Două substanțe care se dizolvă una în alta în orice proporție pentru a forma soluții adevărate se numesc complet solubile reciproc. Astfel de substanțe sunt toate gaze, multe lichide (de exemplu, alcool etilic- apa, glicerina - apa, benzen - benzină), unele solide (de exemplu, argint - aur). Pentru a obține soluții solide, trebuie mai întâi să topești substanțele inițiale, apoi să le amesteci și să le lași să se solidifice. Când sunt complet solubile reciproc, se formează o fază solidă; dacă solubilitatea este parțială, atunci cristalele mici ale unuia dintre componentele originale sunt reținute în solidul rezultat.Dacă două componente formează o fază atunci când sunt amestecate doar în anumite proporții, iar în alte cazuri apar două faze, atunci ele se numesc parțial solubile reciproc. Acestea sunt, de exemplu, apa și benzenul: soluțiile adevărate se obțin din ele numai prin adăugarea unei cantități mici de apă la un volum mare de benzen sau a unei cantități mici de benzen la un volum mare de apă. Dacă amestecați cantități egale de apă și benzen, se formează un sistem lichid în două faze. Stratul său inferior este apă cu o cantitate mică de benzen, iar cel superior
- benzen cu o cantitate mică de apă. Există, de asemenea, substanțe care nu se dizolvă deloc una în alta, de exemplu, apa și mercurul. Dacă două substanțe sunt doar parțial solubile reciproc, atunci la o anumită temperatură și presiune există o limită a cantității unei substanțe care poate forma o soluție adevărată cu cealaltă în condiții de echilibru. O soluție cu o concentrație maximă de dizolvat se numește saturată. De asemenea, puteți prepara o așa-numită soluție suprasaturată, în care concentrația substanței dizolvate este chiar mai mare decât într-una saturată. Cu toate acestea, soluțiile suprasaturate sunt instabile și, cu cea mai mică modificare a condițiilor, de exemplu, cu agitare, pătrunderea particulelor de praf sau adăugarea de cristale ale unei substanțe dizolvate, excesul de dizolvat precipită.Orice lichid începe să fiarbă la temperatura la care presiunea sa de vapori saturați atinge presiunea exterioară. De exemplu, apa sub presiune de 101,3 kPa fierbe la 100
° C deoarece la această temperatură presiunea vaporilor de apă este exact 101,3 kPa. Dacă dizolvați o substanță nevolatilă în apă, presiunea vaporilor acesteia va scădea. Pentru a aduce presiunea de vapori a soluției rezultate la 101,3 kPa, trebuie să încălziți soluția peste 100° C. Rezultă că punctul de fierbere al unei soluții este întotdeauna mai mare decât punctul de fierbere al unui solvent pur. Scăderea punctului de îngheț al soluțiilor este explicată în mod similar.legea lui Raoult. În 1887, fizicianul francez F. Raoult, studiind soluțiile diferitelor lichide și solide nevolatile, a stabilit o lege care leagă scăderea presiunii vaporilor peste soluțiile diluate de neelectroliți cu concentrație: scăderea relativă a presiunii de vapori saturați a solventul de deasupra soluției este egal cu fracția molară a substanței dizolvate. Legea lui Raoult afirmă că creșterea punctului de fierbere sau scăderea punctului de îngheț al unei soluții diluate în comparație cu un solvent pur este proporțională cu concentrația molară (sau fracția molară) a substanței dizolvate și poate fi utilizată pentru a determina greutatea moleculară a acestuia.O soluție al cărei comportament respectă legea lui Raoult se numește ideală. Soluțiile de gaze și lichide nepolare (ale căror molecule nu își schimbă orientarea într-un câmp electric) sunt cele mai apropiate de ideale. În acest caz, căldura soluției este zero, iar proprietățile soluțiilor pot fi prezise direct prin cunoașterea proprietăților componentelor originale și a proporțiilor în care sunt amestecate. Pentru soluții reale nu se poate face o astfel de predicție. Când se formează soluții reale, căldura este de obicei eliberată sau absorbită. Procesele cu eliberare de căldură se numesc exoterme, iar procesele cu absorbție se numesc endoterme.
Se numesc acele caracteristici ale unei soluții care depind în principal de concentrația acesteia (numărul de molecule de substanță dizolvată pe unitatea de volum sau masă a solventului), și nu de natura substanței dizolvate.
coligativ . De exemplu, punctul de fierbere al apei pure la presiunea atmosferică normală este 100° C, iar punctul de fierbere al unei soluții care conține 1 mol de substanță dizolvată (nedisociabilă) în 1000 g de apă este deja 100,52° C indiferent de natura acestei substanțe. Dacă substanța se disociază, formând ioni, atunci punctul de fierbere crește proporțional cu creșterea numărului total de particule de substanță dizolvată, care, datorită disocierii, depășește numărul de molecule ale substanței adăugate în soluție. Alte cantități coligative importante sunt punctul de îngheț al unei soluții, presiunea osmotică și presiunea parțială a vaporilor de solvent.Concentrația soluției este o cantitate care reflectă proporțiile dintre dizolvat și solvent. Concepte calitative precum „diluat” și „concentrat” indică doar faptul că o soluție conține puțin sau mult dizolvat. Pentru a cuantifica concentrația soluțiilor, se folosesc adesea procente (masă sau volum), iar în literatura științifică - numărul de moli sau echivalenți chimici (cm . MASĂ ECHIVALENTĂ)dizolvat pe unitate de masă sau volum de solvent sau soluție. Pentru a evita confuzia, unitățile de concentrare trebuie întotdeauna specificate cu precizie. Luați în considerare următorul exemplu. O soluție formată din 90 g de apă (volumul său este de 90 ml, deoarece densitatea apei este de 1 g/ml) și 10 g de alcool etilic (volumul său este de 12,6 ml, deoarece densitatea alcoolului este de 0,794 g/ml) are o masă de 100 g, dar volumul acestei soluții este de 101,6 ml (și ar fi egal cu 102,6 ml dacă, la amestecarea apei și alcoolului, volumele acestora se adună pur și simplu). Concentrația procentuală a unei soluții poate fi calculată în diferite moduri: sau

Cea mai comună unitate este molaritatea, dar există unele ambiguități de luat în considerare atunci când o calculăm. De exemplu, pentru a obține o soluție 1M a unei substanțe date, o porțiune exactă cântărită egală cu mol este dizolvată într-o cantitate mică de apă cunoscută. masa în grame și aduceți volumul soluției la 1 litru. Cantitatea de apă necesară pentru prepararea acestei soluții poate varia ușor în funcție de temperatură și presiune. Prin urmare, două soluții de un molar preparate în condiții diferite nu au de fapt exact aceleași concentrații. Molalitatea se calculează pe baza unei anumite mase de solvent (1000 g), care nu depinde de temperatură și presiune. În practica de laborator, este mult mai convenabil să se măsoare anumite volume de lichide (pentru aceasta există biurete, pipete și baloane volumetrice) decât să le cântărești, prin urmare, în literatura științifică, concentrațiile sunt adesea exprimate în moli, iar molalitatea este folosit de obicei numai pentru măsurători deosebit de precise.
Normalitatea este folosită pentru a simplifica calculele. După cum am spus deja, substanțele interacționează între ele în cantități corespunzătoare echivalentelor lor. Pregătind soluții de substanțe diferite de aceeași normalitate și luând volume egale, putem fi siguri că acestea conțin același număr de echivalenți.
În cazurile în care este dificil (sau inutil) să se facă distincția între solvent și dizolvat, concentrația este măsurată în fracții molare. Fracțiile molare, precum molalitatea, nu depind de temperatură și presiune.
Cunoscând densitățile solutului și soluției, se poate transforma o concentrație în alta: molaritate în molalitate, fracție molară și invers. Pentru soluțiile diluate ale unui anumit dizolvat și solvent, aceste trei cantități sunt proporționale între ele.
Solubilitate a unei substanțe date este capacitatea sa de a forma soluții cu alte substanțe. Cantitativ, solubilitatea unui gaz, lichid sau solid este măsurată prin concentrația soluției sale saturate la o temperatură dată. Aceasta este o caracteristică importantă a unei substanțe, care ajută la înțelegerea naturii acesteia, precum și influențează cursul reacțiilor în care este implicată această substanță.Gaze. În absența interacțiunii chimice, gazele se amestecă între ele în orice proporție și, în acest caz, nu are rost să vorbim despre saturație. Cu toate acestea, atunci când un gaz se dizolvă într-un lichid, există o anumită concentrație limită, în funcție de presiune și temperatură. Solubilitatea gazelor în unele lichide se corelează cu capacitatea lor de a se lichefia. Gazele cel mai ușor lichefiate, cum ar fi NH 3, HCI, S02 , mai solubile decât gazele dificil de lichefiat, cum ar fi O 2, H2 si el. Dacă există o reacție chimică între solvent și gaz (de exemplu, între apă și NH 3 sau HCl) solubilitatea crește. Solubilitatea unui gaz dat variază în funcție de natura solventului, dar ordinea în care gazele sunt aranjate în funcție de creșterea solubilității rămâne aproximativ aceeași pentru diferiți solvenți.Procesul de dizolvare se supune principiului lui Le Chatelier (1884): dacă un sistem în echilibru este supus oricărei influențe, atunci ca urmare a proceselor care au loc în el, echilibrul se va deplasa în așa direcție încât efectul va scădea. Dizolvarea gazelor în lichide este de obicei însoțită de eliberarea de căldură. În același timp, în conformitate cu principiul lui Le Chatelier, solubilitatea gazelor scade. Această scădere este mai vizibilă cu cât solubilitatea gazelor este mai mare: și astfel de gaze au
căldură mai mare de soluție. Gustul „moale” al apei fiarte sau distilate se explică prin absența aerului în ea, deoarece solubilitatea sa la temperaturi ridicate este foarte scăzută.Pe măsură ce presiunea crește, solubilitatea gazelor crește. Conform legii lui Henry (1803), masa unui gaz care se poate dizolva într-un anumit volum de lichid la o temperatură constantă este proporțională cu presiunea acestuia. Această proprietate este folosită pentru a face băuturi carbogazoase. Dioxidul de carbon se dizolvă în lichid la o presiune de 3-4 atm; în aceste condiții, într-un volum dat se poate dizolva de 3-4 ori mai mult gaz (în masă) decât la 1 atm. Când se deschide un recipient cu un astfel de lichid, presiunea din el scade și o parte din gazul dizolvat este eliberat sub formă de bule. Un efect similar se observă atunci când se deschide o sticlă de șampanie sau se ajunge la suprafața apei subterane saturate cu dioxid de carbon la adâncimi mari.
Când un amestec de gaze este dizolvat într-un lichid, solubilitatea fiecăruia dintre ele rămâne aceeași ca în absența altor componente la aceeași presiune ca și în cazul amestecului (legea lui Dalton).
Lichide. Solubilitatea reciprocă a două lichide este determinată de cât de asemănătoare este structura moleculelor lor („asemănător se dizolvă în asemănător”). Lichidele nepolare, cum ar fi hidrocarburile, se caracterizează prin interacțiuni intermoleculare slabe, astfel încât moleculele unui lichid pătrund ușor între moleculele altuia, adică. lichidele se amestecă bine. În schimb, lichidele polare și nepolare, cum ar fi apa și hidrocarburile, nu se amestecă bine între ele. Fiecare moleculă de apă trebuie mai întâi să scape din mediul altor molecule similare care o atrag puternic spre sine și să pătrundă între moleculele de hidrocarburi care o atrag slab. Dimpotrivă, moleculele de hidrocarburi, pentru a se dizolva în apă, trebuie să se strecoare între moleculele de apă, depășind puternica lor atracție reciprocă, iar aceasta necesită energie. Pe măsură ce temperatura crește, energia cinetică a moleculelor crește, interacțiunile intermoleculare slăbesc, iar solubilitatea apei și a hidrocarburilor crește. Cu o creștere semnificativă a temperaturii, se poate obține solubilitatea lor reciprocă completă. Această temperatură se numește temperatura critică superioară a soluției (UCST).În unele cazuri, solubilitatea reciprocă a două lichide parțial miscibile crește odată cu scăderea temperaturii. Acest efect apare atunci când se generează căldură în timpul amestecării, de obicei ca rezultat al unei reacții chimice. Cu o scădere semnificativă a temperaturii, dar nu sub punctul de îngheț, poate fi atinsă temperatura critică inferioară a soluției (LCST). Se poate presupune că toate sistemele care au LCTE au și HCTE (nu este necesar inversul). Cu toate acestea, în majoritatea cazurilor, unul dintre lichidele de amestecare fierbe la o temperatură sub HTST. Sistemul nicotină-apă are un LCTR de 61
° C, iar VCTR este 208° C. În intervalul 61-208° C, aceste lichide au solubilitate limitată, iar în afara acestui interval au solubilitate reciprocă completă.Solide. Toate solidele prezintă o solubilitate limitată în lichide. Soluțiile lor saturate la o anumită temperatură au o anumită compoziție, care depinde de natura solutului și solventului. Astfel, solubilitatea clorurii de sodiu în apă este de câteva milioane de ori mai mare decât solubilitatea naftalenei în apă, iar atunci când acestea sunt dizolvate în benzen, se observă imaginea opusă. Acest exemplu ilustrează regula generală că un solid se va dizolva cu ușurință într-un lichid cu proprietăți chimice și fizice similare, dar nu se va dizolva într-un lichid cu proprietăți opuse.Sărurile sunt de obicei ușor solubile în apă și mai puțin în alți solvenți polari, cum ar fi alcoolul și amoniacul lichid. Cu toate acestea, solubilitatea sărurilor variază și ea semnificativ: de exemplu, azotatul de amoniu este de milioane de ori mai solubil în apă decât clorura de argint.
Dizolvarea solidelor în lichide este de obicei însoțită de absorbția de căldură și, conform principiului lui Le Chatelier, solubilitatea acestora ar trebui să crească odată cu încălzirea. Acest efect poate fi folosit pentru purificarea substanțelor prin recristalizare. Pentru a face acest lucru, ele sunt dizolvate la temperatură ridicată până când se obține o soluție saturată, apoi soluția este răcită și, după ce substanța dizolvată precipită, filtrată. Există substanțe (de exemplu, hidroxid de calciu, sulfat și acetat), a căror solubilitate în apă scade odată cu creșterea temperaturii.
Solidele, ca și lichidele, se pot dizolva complet unele în altele, formând un amestec omogen - o adevărată soluție solidă, similară cu o soluție lichidă. Substanțele care sunt parțial solubile una în cealaltă formează două soluții solide conjugate de echilibru, ale căror compoziții se modifică cu temperatura.
Coeficientul de distribuție. Dacă o soluție a unei substanțe este adăugată unui sistem de echilibru format din două lichide nemiscibile sau parțial miscibile, atunci aceasta este distribuită între lichide într-o anumită proporție, independent de cantitatea totală a substanței, în absența interacțiunilor chimice în sistem. . Această regulă se numește legea distribuției, iar raportul dintre concentrațiile unei substanțe dizolvate în lichide se numește coeficient de distribuție. Coeficientul de distribuție este aproximativ egal cu raportul dintre solubilitățile unei substanțe date în două lichide, adică. substanța este distribuită între lichide în funcție de solubilitatea sa. Această proprietate este utilizată pentru a extrage o anumită substanță din soluția sa într-un solvent folosind un alt solvent. Un alt exemplu de aplicare a acestuia este procesul de extragere a argintului din minereuri, în care este adesea inclus împreună cu plumbul. Pentru a face acest lucru, la minereul topit se adaugă zinc, care nu se amestecă cu plumbul. Argintul este distribuit între plumbul topit și zinc, în principal în stratul superior al acestuia din urmă. Acest strat este colectat și argintul este separat prin distilare cu zinc.Produs de solubilitate (ETC ). Între exces (precipită) materie solidă M X B y iar soluția sa saturată stabilește un echilibru dinamic descris de ecuațieConstanta de echilibru a acestei reacții esteRemy I. Curs de chimie anorganică , vol. 1-2. M., 1963, 1966
Astăzi, este cunoscută existența a peste 3 milioane de substanțe diferite. Și această cifră crește în fiecare an, deoarece chimiștii sintetici și alți oameni de știință efectuează în mod constant experimente pentru a obține noi compuși care au unele proprietăți utile.
Unele substanțe sunt locuitori naturali, formați în mod natural. Cealaltă jumătate sunt artificiale și sintetice. Cu toate acestea, atât în primul cât și în cel de-al doilea caz, o parte semnificativă este formată din substanțe gazoase, exemple și caracteristici ale cărora le vom lua în considerare în acest articol.
Stări agregate ale substanțelor
Începând cu secolul al XVII-lea, s-a acceptat în general că toți compușii cunoscuți sunt capabili să existe în trei stări de agregare: substanțe solide, lichide și gazoase. Cu toate acestea, cercetările atente din ultimele decenii în domeniile astronomiei, fizicii, chimiei, biologiei spațiale și altor științe au dovedit că există o altă formă. Aceasta este plasmă.
Ce este ea? Acest lucru este parțial sau complet și se dovedește că există o majoritate covârșitoare a acestor substanțe în Univers. Deci, în starea de plasmă se găsesc următoarele:
- materie interstelară;
- materie cosmică;
- straturile superioare ale atmosferei;
- nebuloase;
- compoziția multor planete;
- stele.
Prin urmare, astăzi se spune că există solide, lichide, gaze și plasmă. Apropo, fiecare gaz poate fi transferat artificial în această stare dacă este supus ionizării, adică forțat să se transforme în ioni.
Substanțe gazoase: exemple
Există o mulțime de exemple de substanțe luate în considerare. La urma urmei, gazele sunt cunoscute încă din secolul al XVII-lea, când van Helmont, un om de știință natural, a obținut pentru prima dată dioxid de carbon și a început să-i studieze proprietățile. Apropo, el a dat și numele acestui grup de compuși, deoarece, în opinia sa, gazele sunt ceva dezordonat, haotic, asociat cu spiritele și ceva invizibil, dar tangibil. Acest nume a prins rădăcini în Rusia.
Este posibil să clasificați toate substanțele gazoase, atunci va fi mai ușor să dați exemple. La urma urmei, este dificil să acoperiți toată diversitatea.
După compoziție se disting:
- simplu,
- molecule complexe.
Primul grup îi include pe cei care constau din atomi identici în orice cantitate. Exemplu: oxigen - O 2, ozon - O 3, hidrogen - H 2, clor - CL 2, fluor - F 2, azot - N 2 și altele.
- hidrogen sulfurat - H2S;
- acid clorhidric - HCL;
- metan - CH4;
- dioxid de sulf - SO2;
- gaz brun - NO 2;
- freon - CF 2 CL 2;
- amoniac - NH 3 și altele.

Clasificarea substanţelor după natura
De asemenea, puteți clasifica tipurile de substanțe gazoase în funcție de apartenența lor la lumea organică și anorganică. Adică prin natura atomilor care o alcătuiesc. Gazele organice sunt:
- primii cinci reprezentanți (metan, etan, propan, butan, pentan). Formula generală CnH2n+2;
- etilenă - C2H4;
- acetilenă sau etilenă - C2H2;
- metilamină - CH 3 NH 2 și altele.
O altă clasificare care poate fi aplicată compușilor în cauză este împărțirea în funcție de particulele pe care le conțin. Nu toate substanțele gazoase sunt formate din atomi. Exemple de structuri în care sunt prezenți ioni, molecule, fotoni, electroni, particule browniene și plasmă se referă, de asemenea, la compuși în această stare de agregare.
Proprietățile gazelor
Caracteristicile substanțelor din starea luată în considerare diferă de cele ale compușilor solizi sau lichizi. Chestia este că proprietățile substanțelor gazoase sunt speciale. Particulele lor sunt ușor și rapid mobile, substanța în ansamblu este izotropă, adică proprietățile nu sunt determinate de direcția de mișcare a structurilor incluse în compoziție.
Este posibil să se identifice cele mai importante proprietăți fizice ale substanțelor gazoase, care le vor distinge de toate celelalte forme de existență a materiei.
- Acestea sunt conexiuni care nu pot fi văzute, controlate sau simțite prin mijloace umane obișnuite. Pentru a înțelege proprietățile și a identifica un anumit gaz, aceștia se bazează pe patru parametri care îi descriu pe toți: presiunea, temperatura, cantitatea de substanță (mol), volumul.
- Spre deosebire de lichide, gazele sunt capabile să ocupe întregul spațiu fără urmă, limitate doar de dimensiunea vasului sau a încăperii.
- Toate gazele se amestecă ușor între ele, iar acești compuși nu au o interfață.
- Există reprezentanți mai ușori și mai grei, așa că sub influența gravitației și a timpului, este posibil să se vadă separarea lor.
- Difuzia este una dintre cele mai importante proprietăți ale acestor compuși. Capacitatea de a pătrunde în alte substanțe și de a le satura din interior, efectuând în același timp mișcări complet dezordonate în structura sa.
- Gazele reale nu pot conduce curentul electric, dar dacă vorbim despre substanțe rarefiate și ionizate, atunci conductivitatea crește brusc.
- Capacitatea termică și conductibilitatea termică a gazelor sunt scăzute și variază între diferitele specii.
- Vâscozitatea crește odată cu creșterea presiunii și a temperaturii.
- Există două opțiuni pentru tranziția interfazelor: evaporarea - un lichid se transformă în vapori, sublimarea - o substanță solidă, ocolind cea lichidă, devine gazoasă.
O trăsătură distinctivă a vaporilor din gazele adevărate este că primii, în anumite condiții, sunt capabili să se transforme într-o fază lichidă sau solidă, în timp ce cei din urmă nu sunt. De asemenea, trebuie remarcat faptul că compușii în cauză sunt capabili să reziste la deformare și să fie fluidi.

Astfel de proprietăți ale substanțelor gazoase le permit să fie utilizate pe scară largă în diferite domenii ale științei și tehnologiei, industriei și economiei naționale. În plus, caracteristicile specifice sunt strict individuale pentru fiecare reprezentant. Am luat în considerare doar trăsăturile comune tuturor structurilor reale.
Compresibilitatea
La diferite temperaturi, precum și sub influența presiunii, gazele sunt capabile să se comprima, crescându-și concentrația și reducându-și volumul ocupat. La temperaturi ridicate se extind, la temperaturi scăzute se contractă.
Modificările apar și sub presiune. Densitatea substanțelor gazoase crește și, la atingerea unui punct critic, care este diferit pentru fiecare reprezentant, se poate produce o trecere la o altă stare de agregare.

Principalii oameni de știință care au contribuit la dezvoltarea studiului gazelor
Există mulți astfel de oameni, deoarece studiul gazelor este un proces intensiv de muncă și de lungă durată istorică. Să ne oprim asupra celor mai cunoscute personalități care au reușit să facă cele mai semnificative descoperiri.
- a făcut o descoperire în 1811. Nu contează ce fel de gaze, principalul lucru este că, în aceleași condiții, un volum conține o cantitate egală din ele în ceea ce privește numărul de molecule. Există o valoare calculată numită după numele omului de știință. Este egal cu 6,03 * 10 23 de molecule pentru 1 mol de orice gaz.
- Fermi - a creat teoria unui gaz cuantic ideal.
- Gay-Lussac, Boyle-Marriott - numele oamenilor de știință care au creat ecuațiile cinetice de bază pentru calcule.
- Robert Boyle.
- John Dalton.
- Jacques Charles și mulți alți oameni de știință.
Structura substanțelor gazoase
Cea mai importantă caracteristică în construcția rețelei cristaline a substanțelor luate în considerare este că nodurile sale conțin fie atomi, fie molecule care sunt conectate între ele prin legături covalente slabe. Forțele Van der Waals sunt prezente și atunci când vine vorba de ioni, electroni și alte sisteme cuantice.
Prin urmare, principalele tipuri de structuri ale rețelelor de gaze sunt:
- atomic;
- molecular.
Legăturile din interior se rup ușor, astfel încât aceste conexiuni nu au o formă constantă, ci umplu întreg volumul spațial. Acest lucru explică, de asemenea, lipsa conductibilității electrice și conductibilitatea termică slabă. Dar gazele au o izolare termică bună, deoarece, datorită difuziei, ele sunt capabile să pătrundă în solide și să ocupe spații de grup liber în interiorul lor. În același timp, aerul nu este trecut, căldura este reținută. Aceasta este baza pentru utilizarea combinată a gazelor și solidelor în scopuri de construcție.

Substanțe simple printre gaze
Am discutat deja mai sus care gaze aparțin acestei categorii din punct de vedere al structurii și structurii. Acestea sunt cele care constau din atomi identici. Pot fi date multe exemple, deoarece o parte semnificativă a nemetalelor din întregul tabel periodic există în condiții normale tocmai în această stare de agregare. De exemplu:
- fosfor alb - unul dintre acest element;
- azot;
- oxigen;
- fluor;
- clor;
- heliu;
- neon;
- argon;
- cripton;
- xenon.
Moleculele acestor gaze pot fi fie monoatomice (gaze nobile) fie poliatomice (ozon - O 3). Tipul de legătură este covalent nepolar, în majoritatea cazurilor este destul de slab, dar nu în toate. Rețeaua cristalină este de tip molecular, ceea ce permite acestor substanțe să treacă cu ușurință de la o stare de agregare la alta. De exemplu, iodul în condiții normale este cristale violet închis cu un luciu metalic. Cu toate acestea, atunci când sunt încălzite, se sublimă în nori de gaz violet strălucitor - I 2.

Apropo, orice substanță, inclusiv metalele, poate exista în stare gazoasă în anumite condiții.
Compuși complecși de natură gazoasă
Astfel de gaze, desigur, sunt majoritatea. Diverse combinații de atomi din molecule, uniți prin legături covalente și interacțiuni van der Waals, permit formarea a sute de reprezentanți diferiți ai stării de agregare considerate.
Exemple de substanțe complexe dintre gaze pot fi toți compușii formați din două sau mai multe elemente diferite. Aceasta poate include:
- propan;
- butan;
- acetilenă;
- amoniac;
- silan;
- fosfină;
- metan;
- disulfură de carbon;
- dioxid de sulf;
- gaz brun;
- freon;
- etilenă și altele.
Rețea cristalină de tip molecular. Mulți dintre reprezentanți se dizolvă ușor în apă, formând acizii corespunzători. Majoritatea acestor compuși reprezintă o parte importantă a sintezelor chimice efectuate în industrie.
Metanul și omologii săi
Uneori, conceptul general de „gaz” se referă la un mineral natural, care este un întreg amestec de produse gazoase de natură predominant organică. Conține substanțe precum:
- metan;
- etan;
- propan;
- butan;
- etilenă;
- acetilenă;
- pentan și alții.
În industrie, acestea sunt foarte importante, deoarece amestecul propan-butan este gazul menajer cu care oamenii gătesc, care este folosit ca sursă de energie și căldură.

Multe dintre ele sunt folosite pentru sinteza alcoolilor, aldehidelor, acizilor și a altor substanțe organice. Consumul anual de gaze naturale se ridică la trilioane de metri cubi, iar acest lucru este destul de justificat.
Oxigen și dioxid de carbon
Ce substanțe gazoase pot fi numite cele mai răspândite și cunoscute chiar și de către elevii de clasa întâi? Răspunsul este evident - oxigen și dioxid de carbon. La urma urmei, ei sunt participanții direcți la schimbul de gaze care are loc în toate ființele vii de pe planetă.
Se știe că datorită oxigenului este posibilă viața, deoarece numai unele tipuri de bacterii anaerobe pot exista fără el. Iar dioxidul de carbon este un produs „alimentar” necesar pentru toate plantele care îl absorb pentru a desfășura procesul de fotosinteză.
Din punct de vedere chimic, atât oxigenul, cât și dioxidul de carbon sunt substanțe importante pentru realizarea sintezei compușilor. Primul este un agent oxidant puternic, al doilea este mai des un agent reducător.
Halogeni
Acesta este un grup de compuși în care atomii sunt particule dintr-o substanță gazoasă, conectate în perechi între ele printr-o legătură covalentă nepolară. Cu toate acestea, nu toți halogenii sunt gaze. Bromul este un lichid în condiții obișnuite, iar iodul este un solid ușor de sublimat. Fluorul și clorul sunt substanțe toxice periculoase pentru sănătatea ființelor vii, care sunt agenți oxidanți puternici și sunt utilizate pe scară largă în sinteze.
Exercițiul 1. Introduceți aceste adjective în loc de puncte lichid, solid, gazos .
Exercițiul 2. Răspunde la întrebări.
1. Ce substanțe se găsesc în natură?
2. In ce stare este sarea?
3. În ce stare este bromul?
4. În ce stare este azotul?
5. În ce stare se află hidrogenul și oxigenul?
Exercițiul 3. Introduceți cuvintele necesare în loc de puncte.
1. Există... substanțe în natură.
2. Bromul este în... stare.
3. Sarea este... o substanță.
4. Azotul este în... stare.
5. Hidrogenul și oxigenul sunt... substanțe.
6. Sunt în... stare.
Exercițiul 4. Ascultă textul. Citiți-o cu voce tare.
Substanțele chimice sunt solubile sau insolubile în apă. De exemplu, sulful (S) este insolubil în apă. Iodul (I 2) este, de asemenea, insolubil în apă. Oxigenul (O 2) și azotul (N 2) sunt slab solubili în apă. Acestea sunt substanțe care sunt ușor solubile în apă. Unele substanțe chimice se dizolvă bine în apă, cum ar fi zahărul.
Exercițiul 5. Răspunde la întrebările la textul exercițiului 4. Notează-ți răspunsurile în caiet.
1. Ce substanțe nu se dizolvă în apă?
2. Ce substanțe se dizolvă bine în apă?
3. Ce substanțe știți care sunt ușor solubile în apă?
Exercițiul 6. Completați propozițiile.
1. Substanțele chimice se dizolvă sau...
2. Unele substanțe chimice sunt bune...
3. Glucoza si zaharoza...
4. Oxigenul și azotul sunt dăunătoare...
5. sulf si iod...
Exercițiul 7. Scrie propoziții. Folosiți cuvintele dintre paranteze în forma corectă.
1. Sarea se dizolvă în (apă obișnuită).
2. Unele grăsimi se dizolvă în (benzină).
3. Argintul se dizolvă în (acid azotic).
4. Multe metale se dizolvă în (acid sulfuric - H 2 SO 4).
5. Sticla nu se dizolvă nici măcar în (acid clorhidric - HCl).
6. Oxigenul și azotul sunt slab solubile în (apă).
7. Iodul se dizolvă bine în (alcool sau benzen).
Exercițiul 8. Ascultă textul. Citiți-o cu voce tare.
Toate substanțele au proprietăți fizice. Proprietățile fizice sunt culoarea, gustul și mirosul. De exemplu, zahărul este de culoare albă și are gust dulce. Clorul (Cl 2) are o culoare galben-verzuie și un miros puternic, neplăcut. Sulful (S) are culoarea galbenă, iar bromul (Br 2) este roșu închis. Grafitul (C) este de culoare gri închis, iar cuprul (Cu) este roz deschis. Sarea NaCl este de culoare albă și are un gust sărat. Unele săruri au un gust amar. Bromul are un miros înțepător.
Exercițiul 9. Răspunde la întrebările la textul exercițiului 8. Notează răspunsurile în caiet.
1. Ce proprietăți fizice cunoașteți?
2. Ce proprietăți fizice are zahărul?
3. Ce proprietăți fizice are clorul?
4. Ce culoare sunt grafitul, sulful, bromul și cuprul?
5. Ce proprietăți fizice are clorura de sodiu (NaCl)?
6. Ce gust au unele săruri?
7. Cum miroase bromul?
Exercițiul 10. Alcătuiește propoziții pe baza modelului.
Probă: Azotul este gust. Azotul nu are gust. Azotul nu are gust. Azotul este o substanță fără gust.
1. Clorura de sodiu - miros. -...
2. Creta – gust și miros. -...
3. Alcoolul este culoare. -...
4. Apa – gust, culoare și miros. -...
5. Zahărul este un miros. -...
6. Grafit – gust și miros. –….
Exercițiul 11. Spuneți că substanțele au aceleași proprietăți ca și apa.
Probă: Apa este o substanță complexă, alcoolul etilic este și o substanță complexă.
1. Apa este un lichid, acid azotic de asemenea...
2. Apa este o substanță transparentă, și acidul sulfuric...
3. Apa nu are culoare, nici diamantul...
4. Apa nu are miros, nici oxigenul... .
Exercițiul 12. Spuneți că apa are calități diferite decât alcoolul etilic.
1. Alcoolul etilic este un lichid ușor, iar apa...
2. Alcoolul etilic are un miros caracteristic, iar apa...
3. Alcoolul etilic are un punct de fierbere scăzut, iar apa...
Exercițiul 13. Clarifică următoarele mesaje, folosește cuvinte caracteristic, specific, ascuțit, violet, roșu-brun, incolor, înalt, galben .
Probă: Bromul este un lichid închis la culoare. Bromul este un lichid roșu închis.
1. Alcoolul etilic are un miros. 2. Iodul are un miros. 3. Vaporii de iod sunt colorați. 4. Soluție de iod închis. 5. Acidul sulfuric este un lichid. 6. Acidul sulfuric are punct de fierbere. 7. Sulful are culoare.
Exercițiul 14. Vorbește despre proprietățile fizice ale substanțelor, folosește cuvintele și expresiile date.
1. Fluor (F 2) – gaz – culoare verde deschis – miros înțepător – otrăvitor.
2. Clor (Cl 2) – gaz – culoare galben-verzuie – miros înțepător – otrăvitor.