Εξάρτηση των ιδιοτήτων των ουσιών από αυτές
κτίρια. Χημικός δεσμός. Βασικός
είδη χημικών δεσμών.
Θέματα που καλύπτονται:
1. Επίπεδα οργάνωσης της ύλης. Ιεραρχία δομής.
2. Ουσίες μοριακής και μη μοριακής δομής.
3.
4. Λόγοι εμφάνισης χημικών δεσμών.
5. Ομοιοπολικός δεσμός: μηχανισμοί σχηματισμού, μέθοδοι
ατομική τροχιακή επικάλυψη, πολικότητα, διπολική ροπή
μόρια.
6. Ιωνικός δεσμός.
7. Σύγκριση πολικών ομοιοπολικών και ιοντικών δεσμών.
8. Σύγκριση ιδιοτήτων ουσιών με ομοιοπολικό πολικό και
ιοντικούς δεσμούς.
9. Μεταλλική σύνδεση.
10. Διαμοριακές αλληλεπιδράσεις. Ουσία (πάνω από 70 εκατομμύρια)
Τι πρέπει να γνωρίζετε για κάθε ουσία;
Φόρμουλα (από τι αποτελείται)
Δομή (πώς λειτουργεί)
Φυσικές ιδιότητες
Χημικές ιδιότητες
Μέθοδοι απόκτησης
(εργαστήριο και βιομηχανικό)
6. Πρακτική εφαρμογή
1.
2.
3.
4.
5.Ιεραρχία της δομής της ύλης
Όλες οι ουσίες
αποτελείται από
άτομα, αλλά όχι
όλα είναι από
μόρια.
Ατομο
Μόριο
Για όλες τις ουσίες
Μόνο για ουσίες
μοριακός
κτίρια
Νανο επίπεδο
Για όλες τις ουσίες
Ογκομετρική (μακροεντολή)
επίπεδο
Για όλες τις ουσίες
Και τα 4 επίπεδα αποτελούν αντικείμενο μελέτης χημείας Μοριακές ουσίες
και μη μοριακή δομή Ουσίες
Μοριακός
κτίρια
Μη μοριακό
κτίρια
Αποτελείται από μόρια
Αποτελείται από άτομα
ή ιόντα
H2O, CO2, HNO3, C60,
σχεδόν όλα οργαν. ουσίες
Διαμάντι, γραφίτης, SiO2,
μέταλλα, άλατα
Ο τύπος αντανακλά
μοριακή σύνθεση
Η φόρμουλα αντικατοπτρίζει τη σύνθεση
μονάδα τύπου Ουσίες
Χλωριούχο νάτριο
Μονάδα τύπου NaCl Ουσίες
Πυρίτιο
Μονάδα τύπου SiO2
Το Ορυκτολογικό Μουσείο Fersman βρίσκεται κοντά στην είσοδο του κήπου Neskuchny.
Διεύθυνση: Μόσχα, Leninsky Prospekt, κτίριο 18, κτίριο 2. Ποικιλία χημικών δομών.
προωθητικό
C5H6
Κορόνεν
(υπερβενζόλιο)
C24H12
cavitand
C36H32O8 Ποικιλία χημικών δομών.
κατενάνη Ποικιλία χημικών δομών.
κατενάνη Ποικιλία χημικών δομών.
Λωρίδα Mobius Μόριο
Ένα μόριο είναι ένα σταθερό σύστημα που αποτελείται από πολλά
ατομικούς πυρήνες και ηλεκτρόνια.
Τα άτομα συνδυάζονται σε μόρια σχηματίζοντας
χημικοί δεσμοί.
Η κύρια κινητήρια δύναμη για το σχηματισμό ενός μορίου από
άτομα – μείωση της συνολικής ενέργειας.
Τα μόρια έχουν γεωμετρικό σχήμα που χαρακτηρίζεται από
αποστάσεις μεταξύ πυρήνων και γωνίες μεταξύ δεσμών. Κύρια κινητήρια δύναμη
σχηματισμός χημικού δεσμού
ανάμεσα σε σωματίδια ύλης -
μείωση της συνολικής ενέργειας
συστήματα. Κύριοι τύποι χημικών
συνδέσεις:
1.Ιωνικό
2.Ομοιοπολική
3.Μέταλλο
Βασική διαμοριακή
αλληλεπιδράσεις:
1.Δεσμοί υδρογόνου
2. Συνδέσεις Van der Waals Ιοντικός δεσμός
Αν ένας δεσμός σχηματίζεται από άτομα με έντονα διαφορετικά
τιμές ηλεκτραρνητικότητας (ΔOOE ≥ 1,7),
κοινό ζεύγος ηλεκτρονίων σχεδόν πλήρως
μετατοπίζεται προς πιο ηλεκτραρνητικά
άτομο.
Na Cl
ΟΕΟ 0,9 3,16
∆ 2,26
+Να
Ανιόν
:Clcation
Χημικός δεσμός μεταξύ ιόντων που εμφανίζεται
λόγω της ηλεκτροστατικής τους έλξης,
ονομάζεται ιοντικό. Ιοντικός δεσμός
Το δυναμικό Coulomb είναι σφαιρικό
συμμετρικά, κατευθυνόμενα προς όλες τις κατευθύνσεις,
επομένως ο ιονικός δεσμός είναι μη κατευθυντικός.
Coulomb δυναμικό δεν έχει
περιορισμούς στην ποσότητα
προστέθηκαν αντίθετα ιόντα -
εξ ου και ο ιονικός δεσμός
ακόρεστος. Ιοντικός δεσμός
Ενώσεις με τύπο ιοντικού δεσμού
στερεό, πολύ διαλυτό σε
πολικοί διαλύτες, έχουν υψηλή
σημεία τήξης και βρασμού. Ιοντικός δεσμός
Καμπύλη I: έλξη ιόντων αν
θα εκπροσωπούσαν
χρεώσεις πόντων.
Καμπύλη II: απώθηση πυρήνων σε
σε περίπτωση στενής γειτνίασης ιόντων.
Καμπύλη III: ελάχιστη ενέργεια E0 στο
αντιστοιχεί στην καμπύλη
κατάσταση ισορροπίας ιοντικών
ζευγάρια, στα οποία οι δυνάμεις
έλξη ηλεκτρονίων προς πυρήνες
αποζημιώνονται από δυνάμεις
απώθηση πυρήνων μεταξύ τους
απόσταση r0, Χημικός δεσμός σε μόρια
Οι χημικοί δεσμοί σε μόρια μπορούν να περιγραφούν με
θέσεις δύο μεθόδων:
- μέθοδος δεσμών σθένους, MBC
- μέθοδος μοριακής τροχιάς, MMO Μέθοδος δεσμού σθένους
Θεωρία Heitler-London
Βασικές διατάξεις της μεθόδου BC:
1. Ένας δεσμός σχηματίζεται από δύο ηλεκτρόνια με αντίθετα
περιστρέφεται και τα κυματικά κύματα επικαλύπτονται
συναρτήσεις και την πυκνότητα ηλεκτρονίων μεταξύ
πυρήνες.
2. Η σύνδεση είναι εντοπισμένη στην κατεύθυνση της μέγιστης
επικαλυπτόμενες Ψ-συναρτήσεις ηλεκτρονίων. Όσο πιο δυνατός
επικαλύπτονται, τόσο ισχυρότερος είναι ο δεσμός.
dsv - μήκος
διαβιβάσεις;
ESV - ενέργεια
διαβιβάσεις. Σχηματισμός μορίου υδρογόνου:
N· + ·N → N:N
Όταν δύο άτομα ενωθούν
προκύπτουν ελκτικές δυνάμεις και
αποστροφή:
1) έλξη: «ηλεκτρόνιο-πυρήνας»
γειτονικά άτομα.
2) απωθημένα: «πυρήνα σε πυρήνα»,
«ηλεκτρόνιο-ηλεκτρόνιο» γειτονικό
άτομα. Σχηματισμός μορίου υδρογόνου:
Μοριακός
σύννεφο δύο ηλεκτρονίων,
έχοντας μέγιστο
πυκνότητα ηλεκτρονίων. Χημικός δεσμός που πραγματοποιείται από κοινού
Τα ζεύγη ηλεκτρονίων ονομάζονται ομοιοπολικά.
Ένα κοινό ζεύγος ηλεκτρονίων μπορεί να σχηματιστεί από δύο
τρόποι:
1) ως αποτέλεσμα της ένωσης δύο μη ζευγαρωμένων ηλεκτρονίων:
2) ως αποτέλεσμα της κοινωνικοποίησης του αδιαίρετου
ζεύγος ηλεκτρονίων ενός ατόμου (δότης) και κενό
τροχιακά άλλου (αποδέκτη).
Δύο μηχανισμοί για το σχηματισμό ομοιοπολικών δεσμών:
ανταλλαγή και δωρητής-αποδέκτης.
Η πυκνότητα επικοινωνίας εμφανίζεται κατά μήκος της γραμμής,
συνδέοντας τα κέντρα των ατόμων (πυρήνες), τότε αυτό
η επικάλυψη ονομάζεται σ-σύζευξη: Μέθοδοι επικάλυψης ατομικών τροχιακών με
σχηματισμός ομοιοπολικού δεσμού
Εάν ο σχηματισμός μέγιστης ηλεκτρονικής
Η πυκνότητα του δεσμού εμφανίζεται και στις δύο πλευρές
γραμμή που συνδέει τα κέντρα των ατόμων (πυρήνες), τότε
μια τέτοια επικάλυψη ονομάζεται π-δεσμός: Πολικός και μη πολικός ομοιοπολικός δεσμός
1) Εάν ο δεσμός σχηματίζεται από πανομοιότυπα άτομα,
σύννεφο επικοινωνίας δύο ηλεκτρονίων κατανεμημένο σε
χώρο συμμετρικά μεταξύ των πυρήνων τους - τέτοιοι
ο δεσμός ονομάζεται μη πολικός: H2, Cl2, N2.
2) εάν ο δεσμός σχηματίζεται από διαφορετικά άτομα, το σύννεφο του δεσμού
μετατοπίστηκε προς το πιο ηλεκτραρνητικό άτομο
- ένας τέτοιος δεσμός ονομάζεται πολικός: HCl, NH3, CO2. Πολικός ομοιοπολικός δεσμός
Διπολική στιγμή σύζευξης
δίπολο
Η+δCl-δ ή Η+0,18Cl-0,18
Όπου το ±δ είναι αποτελεσματικό
ατομικό φορτίο, κλάσμα
απόλυτη χρέωση
ηλεκτρόνιο.
+δ
-δ
Δεν πρέπει να συγχέεται με την κατάσταση οξείδωσης!
μεγάλο
Προϊόν ενεργού φορτίου και μήκους διπόλου
ονομάζεται ηλεκτρική ροπή του διπόλου: μ = δl
Αυτό είναι ένα διανυσματικό μέγεθος: κατευθυνόμενο από το θετικό
φορτίο σε αρνητικό. Πολικός ομοιοπολικός δεσμός
Διπολική ροπή ενός μορίου
Η διπολική ροπή ενός μορίου είναι ίση με το άθροισμα
διανύσματα διπολικών ροπών δεσμών, λαμβάνοντας υπόψη
μόνα ζεύγη ηλεκτρονίων.
Μονάδα διπολικής ροπής
είναι Debye: 1D = 3,3·10-30 C·m. Πολικός ομοιοπολικός δεσμός
Διπολική ροπή ενός μορίου
Στο γινόμενο μ = δl και οι δύο ποσότητες κατευθύνονται αντίθετα.
Επομένως, πρέπει να παρακολουθούμε προσεκτικά την αιτία
αλλαγές μ.
Για παράδειγμα,
CsF
CsCl
24
31
δ “χαμένος” l
CsI
HF
HCl
HBr
ΓΕΙΑ
37
5,73
3,24
2,97
1,14
αντίστροφα Πολικός ομοιοπολικός δεσμός
Διπολική ροπή ενός μορίου
Μπορεί ένα μόριο να είναι μη πολικό αν
Είναι όλες οι συνδέσεις σε αυτό πολικές;
Τα μόρια τύπου ΑΒ είναι πάντα πολικά.
Τα μόρια τύπου AB2 μπορεί να είναι τόσο πολικά όσο και
μη πολικό...
H2O
ΣΧΕΤΙΚΑ ΜΕ
Ν
CO2
μ>0
Ν
ΣΧΕΤΙΚΑ ΜΕ
ΜΕ
μ=0
ΣΧΕΤΙΚΑ ΜΕ Πολικός ομοιοπολικός δεσμός
Μόρια που αποτελούνται από τρία ή περισσότερα άτομα
(AB2, AB3, AB4, AB5, AB6) ,
μπορεί να είναι μη πολικές εάν είναι συμμετρικές.
Τι επηρεάζει η παρουσία διπολικής ροπής;
μόρια;
Υπάρχουν διαμοριακές αλληλεπιδράσεις και
Κατά συνέπεια, η πυκνότητα της ουσίας αυξάνεται,
θερμοκρασία τήξης και θερμοκρασία βρασμού. Σύγκριση ιοντικών και ομοιοπολικών πολικών δεσμών
Γενικά: γενική εκπαίδευση
ζεύγος ηλεκτρονίων.
Διαφορά: πτυχίο
γενική μετατόπιση
ζεύγος ηλεκτρονίων
(πόλωση ομολόγων).
Ο ιοντικός δεσμός πρέπει να θεωρείται ως ακραίος
η περίπτωση ενός πολικού ομοιοπολικού δεσμού.
πολικούς δεσμούς
Ομοιοπολικός δεσμός: κορεσμένος και κατευθυνόμενος
Κορεσμός (μέγιστο σθένος) -
καθορίζεται από την ικανότητα ενός ατόμου να σχηματίζει
περιορισμένος αριθμός συνδέσεων (λαμβάνοντας υπόψη και τα δύο
μηχανισμοί σχηματισμού).
Η κατεύθυνση του δεσμού καθορίζεται από τη γωνία δεσμού, η οποία εξαρτάται από
τύπος υβριδισμού των τροχιακών του κεντρικού ατόμου.
Ιωνικός δεσμός: ακόρεστος και μη κατευθυντικός. Σύγκριση χαρακτηριστικών ιοντικών και ομοιοπολικών
πολικούς δεσμούς
Η κατεύθυνση του δεσμού καθορίζεται από τις γωνίες δεσμού.
Οι γωνίες δεσμών προσδιορίζονται πειραματικά ή
προβλέπονται με βάση τη θεωρία υβριδισμού
ατομικά τροχιακά του L. Paulling ή θεωρία
Gillespie.
Περισσότερες λεπτομέρειες για αυτό στα σεμινάρια.
ομοιοπολικούς δεσμούς
Ομοιοπολικούς δεσμούς
Ατομικοί κρύσταλλοι
Μεταξύ ατόμων
στον ίδιο τον κρύσταλλο
Υψηλή σκληρότητα
υψηλό tº λιώνει, tº βράζει
κακή ζέστη και
ηλεκτρική αγωγιμότητα
Μοριακοί κρύσταλλοι
Μεταξύ ατόμων
σε ένα μόριο
Μέτρια απαλότητα
αρκετά χαμηλά
tº λιώσει, tº βράσει
κακή ζέστη και
Ηλεκτρική αγωγιμότητα
Αδιάλυτο στο νερό Σύγκριση ιδιοτήτων ουσιών με ιοντικά και
ομοιοπολικούς δεσμούς
μοριακός κρύσταλλος
Σημείο τήξεως 112,85 °C Σύγκριση ιδιοτήτων ουσιών με ιοντικά και
ομοιοπολικούς δεσμούς
Ατομικός ομοιοπολικός κρύσταλλος
Σημείο τήξεως ≈ 3700 °C Σύγκριση ιδιοτήτων ουσιών με ιοντικά και
ομοιοπολικούς δεσμούς
Ιωνικοί δεσμοί
μεταξύ ιόντων
σε κρύσταλλο
σκληρότητα και ευθραυστότητα
υψηλό σημείο τήξης
κακή θερμική και ηλεκτρική αγωγιμότητα
Διαλυτό στο νερό Σύγκριση ιδιοτήτων ουσιών με ιοντικά και
ομοιοπολικούς δεσμούς
Ιωνικός κρύσταλλος
Σημείο τήξεως ≈ 800 °C Μεταλλική σύνδεση
Ο μεταλλικός δεσμός πραγματοποιείται από ηλεκτρόνια,
που ανήκει σε όλα τα άτομα ταυτόχρονα.
Πυκνότητα ηλεκτρονίων
Το «αέριο ηλεκτρονίων» μετατοπίζεται.
Χαρακτηριστικό γνώρισμα
μεταλλική λάμψη
Πλαστική ύλη
Εύπλαστο
Υψηλή ζέστη και
ηλεκτρική αγωγιμότητα
Σημεία τήξης
πραγματικά διαφορετικό. Διαμοριακούς δεσμούς.
1. Δεσμός υδρογόνου
Έλξη μεταξύ του ατόμου υδρογόνου (+) του ενός
μόριο και το άτομο F, O, N (–) άλλου μορίου
φά
φά
H
H
H
H
φά
φά
Ο
H3C
H
φά
ντο
H
Πολυμερές
(HF)n
Ο
ντο
Ο
H
CH3
Dimer
οξικό οξύ
Ο
Οι δεσμοί υδρογόνου είναι αδύναμοι μεμονωμένα,
αλλά ισχυρά συλλογικά Διαμοριακούς δεσμούς.
2. Δεσμός υδρογόνου στο DNA Διαμοριακούς δεσμούς.
3. Δεσμοί υδρογόνου στο νερό
υγρό νερό
πάγος Διαμοριακούς δεσμούς.
4. Σχηματισμός δεσμών υδρογόνου σε
νερό
υγρό νερό
μεταμόρφωση
νερό σε πάγο Διαμοριακούς δεσμούς.
5. Συνδέσεις Van der Waals
Ακόμα κι αν δεν υπάρχουν δεσμοί υδρογόνου μεταξύ των μορίων,
τα μόρια πάντα έλκονται μεταξύ τους.
Η έλξη μεταξύ των μοριακών διπόλων ονομάζεται σύζευξη van der Waals.
Όσο ισχυρότερη είναι η έλξη:
1) πολικότητα? 2) μοριακό μέγεθος.
Παράδειγμα: μεθάνιο (CH4) – αέριο, βενζόλιο (C6H6) – υγρό
Ένας από τους πιο αδύναμους δεσμούς c-d-v είναι μεταξύ μορίων
H2 (σ.τ. –259 oC, bp. –253 oC).
Η αλληλεπίδραση μεταξύ των μορίων είναι πολλές φορές πιο αδύναμη από τον δεσμό μεταξύ των ατόμων:
Ekow(Cl–Cl) = 244 kJ/mol, Evdv(Cl2–Cl2) = 25 kJ/mol
αλλά είναι ακριβώς αυτό που εξασφαλίζει την ύπαρξη της υγρής και στερεάς κατάστασης της ύλης Στη διάλεξη χρησιμοποιήθηκε υλικό από τον καθηγητή
Σχολή Χημείας, Κρατικό Πανεπιστήμιο της Μόσχας. Λομονόσοφ
Ερεμίν Βαντίμ Βλαντιμίροβιτς
Ευχαριστώ
για την προσοχή σας!
Εξάρτηση των ιδιοτήτων των ουσιών από τη δομή των μορίων
Ένα μάθημα στα ανοιχτά μυαλά
Στόχοι. Εκπαιδευτικό – να εδραιώσει και να εμβαθύνει τις γνώσεις των μαθητών για τη θεωρία της χημικής δομής και τις βασικές αρχές της.
Εκπαιδευτικός– να προωθήσουν τη δημιουργία σχέσεων και σχέσεων αιτίου-αποτελέσματος.
Αναπτυξιακή– ανάπτυξη δεξιοτήτων σκέψης, ικανότητα μεταφοράς γνώσεων και δεξιοτήτων σε νέες καταστάσεις.
Εξοπλισμός και αντιδραστήρια.Ένα σετ μοντέλων με μπίλια και ραβδί. δείγματα φυσικού και συνθετικού καουτσούκ, διαιθυλαιθέρα, βουτανόλης, αιθανόλης, φαινόλης, λιθίου, νατρίου, διαλύματος λακκούβας, βρωμιούχου νερού, μυρμηκικού και οξικού οξέα.
Ρητό.«Κάθε ουσία - από την πιο απλή έως την πιο σύνθετη - έχει τρεις διαφορετικές αλλά αλληλένδετες πτυχές - ιδιότητα, σύνθεση, δομή»(V.M. Kedrov).
ΚΑΤΑ ΤΑ ΜΑΘΗΜΑΤΑ
Τι περιλαμβάνει η έννοια του «εθισμού»; (Μάθετε τις απόψεις των μαθητών).
Γράψτε τον ορισμό στον πίνακα: «Εθισμός είναι
1) η σχέση ενός φαινομένου με ένα άλλο ως συνέπεια μιας αιτίας.
2) υποταγή σε άλλους ελλείψει ανεξαρτησίας, ελευθερία» (λεξικό S.I. Ozhegov).
Θα προσδιορίσουμε μαζί τους στόχους του μαθήματος συντάσσοντας ένα διάγραμμα:
Μπλοκ παρακίνησης προσανατολισμού
Διανοητική προθέρμανση
Προσδιορίστε την ορθότητα των παρακάτω δηλώσεων και υποστηρίξτε τις απαντήσεις σας με παραδείγματα.
Η θεωρία της χημικής δομής ανακαλύφθηκε από τον D.I Mendeleev.
Απάντηση. A.M.Butlerov, 1861
Το σθένος του άνθρακα στις οργανικές ενώσεις μπορεί να είναι II και IV.
Απάντηση. Το σθένος του άνθρακα είναι πιο συχνά IV.
Τα άτομα που σχηματίζουν τα μόρια των οργανικών ουσιών συνδέονται τυχαία, χωρίς να λαμβάνεται υπόψη το σθένος.
Απάντηση. Τα άτομα στα μόρια συνδέονται σε μια συγκεκριμένη αλληλουχία ανάλογα με το σθένος τους.
Οι ιδιότητες των ουσιών δεν εξαρτώνται από τη δομή των μορίων.
Απάντηση. Ο Butlerov, στη θεωρία της χημικής δομής, υποστήριξε ότι οι ιδιότητες των οργανικών ενώσεων καθορίζονται από τη σύνθεση και τη δομή των μορίων τους.
Μονάδα λειτουργιών και εκτέλεσης
Συντελεστής χωρικής δομής
Τι γνωρίζετε για τη χωρική δομή των μορίων των αλκανίων και των αλκενίων;
Απάντηση. Στα αλκάνια, σε κάθε άνθρακα υπάρχουν τέσσερα γειτονικά άτομα, τα οποία βρίσκονται στις κορυφές του τετραέδρου. Ο ίδιος ο άνθρακας βρίσκεται στο κέντρο του τετραέδρου. Τύπος υβριδισμού ατόμων άνθρακα – sp 3, γωνίες μεταξύ δεσμών (H–C–C, H–C–H, C–C–C) - 109°28". Η δομή της ανθρακικής αλυσίδας είναι ζιγκ-ζαγκ.
Στα αλκένια, δύο άτομα άνθρακα που συνδέονται με διπλό δεσμό και τέσσερα άτομα με απλούς δεσμούς βρίσκονται στο ίδιο επίπεδο. Τύπος ατομικού υβριδισμού – sp 2, γωνίες μεταξύ δεσμών (H–C=C, C–C=C) - 120°.
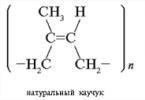
Θυμηθείτε τη διαφορά μεταξύ της χωρικής δομής των μορίων του φυσικού καουτσούκ και του συνθετικού καουτσούκ.
Απάντηση. Το φυσικό καουτσούκ, ένα γραμμικό πολυμερές ισοπρενίου, έχει τη δομή cis-1,4-πολυισοπρένιο. Το συνθετικό καουτσούκ μπορεί να έχει δομή έκσταση-1,4-πολυισοπρένιο.

Αυτά τα λάστιχα έχουν την ίδια ελαστικότητα;
Απάντηση. Η μορφή cis είναι πιο ελαστική από τη μορφή μετασχηματισμού. Τα μόρια του φυσικού καουτσούκ είναι μακρύτερα και πιο ελαστικά στριμμένα (πρώτα σε μια σπείρα και μετά σε μια μπάλα) από τα μόρια του συνθετικού καουτσούκ.
Το άμυλο (C 5 H 10 O 5) m είναι μια λευκή άμορφη σκόνη και η κυτταρίνη (C 5 H 10 O 5) n είναι μια ινώδης ουσία.
Ποιος είναι ο λόγος αυτής της διαφοράς;
Απάντηση. Το άμυλο είναι ένα πολυμερές -γλυκόζης, ενώ η κυτταρίνη είναι ένα πολυμερές -γλυκόζης.

Διαφέρουν οι χημικές ιδιότητες του αμύλου και της κυτταρίνης;
Απάντηση. Άμυλο + I 2 μπλε διάλυμα,
κυτταρίνη + νιτροκυτταρίνη HNO 3.
συμπέρασμα. Τόσο οι φυσικές όσο και οι χημικές ιδιότητες εξαρτώνται από τη χωρική δομή.
Συντελεστής χημικής δομής
Ποια είναι η κύρια ιδέα της θεωρίας της χημικής δομής;
Απάντηση. Η χημική δομή αντανακλά την εξάρτηση των ιδιοτήτων των ουσιών από τη σειρά σύνδεσης των ατόμων και την αλληλεπίδρασή τους.
Προσδιορίστε τι κοινό έχουν οι ουσίες:
Απάντηση. Χημική ένωση.
Συγκρίνετε τις φυσικές ιδιότητες αυτών των ουσιών. Που θεωρείτε ότι οφείλεται αυτή η διαφορά;
Με βάση την κατανομή της πυκνότητας ηλεκτρονίων ενός χημικού δεσμού, ποιο μόριο είναι πιο πολικό; Με τι συνδέεται αυτό;
Απάντηση. – ΟΗ δεσμός υδρογόνου.
Πείραμα επίδειξης

συμπέρασμα. Η αντιδραστικότητα μιας αλκοόλης καθορίζεται από την αμοιβαία επίδραση των ατόμων στο μόριο.
Συντελεστής ηλεκτρονικής δομής
Ποια είναι η ουσία της αμοιβαίας επιρροής των ατόμων;
Απάντηση. Η αμοιβαία επιρροή συνίσταται στην αλληλεπίδραση των ηλεκτρονικών δομών των ατόμων, η οποία οδηγεί σε μετατόπιση της ηλεκτρονικής πυκνότητας των χημικών δεσμών.
Εργαστηριακές εργασίες
Δάσκαλος. Υπάρχουν εργαστηριακά κιτ στα γραφεία σας. Ολοκληρώστε την εργασία και αποδείξτε πειραματικά την εξάρτηση των ιδιοτήτων των ουσιών από την ηλεκτρονική δομή. Δουλέψτε σε ζευγάρια. Τηρείτε αυστηρά τους κανονισμούς ασφαλείας.
Επιλογή Ι. Διεξαγωγή έρευνας σχετικά με τις χημικές ιδιότητες της αιθανόλης και της φαινόλης. Να αποδείξετε την εξάρτηση της αντιδραστικότητάς τους από την ηλεκτρονική τους δομή. Χρησιμοποιήστε αντιδραστήρια - μέταλλο λιθίου και βρωμιούχο νερό. Καταγράψτε τις εξισώσεις για πιθανές αντιδράσεις. Δείξτε τη μετατόπιση της πυκνότητας ηλεκτρονίων ενός χημικού δεσμού στα μόρια.
Επιλογή II. Εξηγήστε την ουσία της αμοιβαίας επίδρασης της καρβοξυλικής ομάδας –COOH και του υποκαταστάτη στον άνθρακα καρβονυλίου στα μόρια του καρβοξυλικού οξέος. Εξετάστε το παράδειγμα μυρμηκικού και οξικού οξέος. Χρησιμοποιήστε διάλυμα λιθίου και λιθίου. Καταγράψτε τις εξισώσεις αντίδρασης. Δείξτε τη μετατόπιση της πυκνότητας ηλεκτρονίων ενός χημικού δεσμού στα μόρια.
συμπέρασμα. Οι χημικές ιδιότητες εξαρτώνται από την αμοιβαία επίδραση των ατόμων.


Τελικός έλεγχος γνώσης
Δάσκαλος. Ας συνοψίσουμε το μάθημά μας. Έχουμε επιβεβαιώσει ότι οι ιδιότητες των ουσιών εξαρτώνται από τη χωρική χημική και ηλεκτρονική δομή.
1. Γράψτε τους τύπους HCOOH, C 6 H 5 OH και C 4 H 9 COOH κατά σειρά αύξησης των όξινων ιδιοτήτων των ουσιών.
2. Τακτοποιήστε τους τύπους CH 3 COOH, C 3 H 7 COOH, CH 3 OH, ClCH 2 COOH σε φθίνουσα σειρά των όξινων ιδιοτήτων των ουσιών.
3. Ποια αλδεΰδη έχει:

πιο ενεργή ομάδα αλδεΰδης; Γιατί;
Αξιολογήστε την εργασία σας στην τάξη.
L.A.EREMINA,
καθηγήτρια χημείας στο σχολείο αρ
(Abakan, Khakassia)
Ομοιοπολικός χημικός δεσμός, οι ποικιλίες και οι μηχανισμοί σχηματισμού του. Χαρακτηριστικά ομοιοπολικών δεσμών (πολικότητα και ενέργεια δεσμού). Ιοντικός δεσμός. Μεταλλική σύνδεση. Δεσμός υδρογόνου
Το δόγμα των χημικών δεσμών αποτελεί τη βάση όλης της θεωρητικής χημείας.
Ως χημικός δεσμός νοείται η αλληλεπίδραση ατόμων που τα συνδέει σε μόρια, ιόντα, ρίζες και κρυστάλλους.
Υπάρχουν τέσσερις τύποι χημικών δεσμών: ιονικοί, ομοιοπολικοί, μεταλλικοί και υδρογόνοι.
Η διαίρεση των χημικών δεσμών σε τύπους είναι υπό όρους, αφού όλοι χαρακτηρίζονται από μια ορισμένη ενότητα.
Ένας ιονικός δεσμός μπορεί να θεωρηθεί ως ακραία περίπτωση πολικού ομοιοπολικού δεσμού.
Ένας μεταλλικός δεσμός συνδυάζει την ομοιοπολική αλληλεπίδραση ατόμων χρησιμοποιώντας κοινά ηλεκτρόνια και την ηλεκτροστατική έλξη μεταξύ αυτών των ηλεκτρονίων και των μεταλλικών ιόντων.
Οι ουσίες συχνά στερούνται περιοριστικών περιπτώσεων χημικού δεσμού (ή καθαρού χημικού δεσμού).
Για παράδειγμα, το φθοριούχο λίθιο $LiF$ ταξινομείται ως ιοντική ένωση. Στην πραγματικότητα, ο δεσμός σε αυτό είναι $80%$ ιοντικός και $20%$ ομοιοπολικός. Είναι λοιπόν πιο σωστό, προφανώς, να μιλάμε για τον βαθμό πολικότητας (ιονικότητας) ενός χημικού δεσμού.
Στη σειρά υδραλογονιδίων $HF—HCl—HBr—HI—HAt$ ο βαθμός της πολικότητας του δεσμού μειώνεται, επειδή η διαφορά στις τιμές ηλεκτραρνητικότητας των ατόμων αλογόνου και υδρογόνου μειώνεται και στο υδρογόνο ασταίνης ο δεσμός γίνεται σχεδόν μη πολικός $(EO(H) = 2,1, EO(At) = 2,2)$.
Διαφορετικοί τύποι δεσμών μπορούν να βρεθούν στις ίδιες ουσίες, για παράδειγμα:
- σε βάσεις: μεταξύ των ατόμων οξυγόνου και υδρογόνου στις υδροξοομάδες ο δεσμός είναι πολικός ομοιοπολικός και μεταξύ του μετάλλου και της υδροξοομάδας είναι ιοντικός.
- σε άλατα οξέων που περιέχουν οξυγόνο: μεταξύ του ατόμου μη μετάλλου και του οξυγόνου του όξινου υπολείμματος - ομοιοπολικό πολικό, και μεταξύ του μετάλλου και του όξινου υπολείμματος - ιοντικό.
- σε άλατα αμμωνίου, μεθυλαμμωνίου κ.λπ.: μεταξύ ατόμων αζώτου και υδρογόνου - ομοιοπολική πολική, και μεταξύ ιόντων αμμωνίου ή μεθυλαμμωνίου και του υπολείμματος οξέος - ιοντικό.
- στα υπεροξείδια μετάλλων (για παράδειγμα, $Na_2O_2$), ο δεσμός μεταξύ των ατόμων οξυγόνου είναι ομοιοπολικός μη πολικός και μεταξύ του μετάλλου και του οξυγόνου είναι ιοντικός κ.λπ.
Διαφορετικοί τύποι συνδέσεων μπορούν να μεταμορφωθούν ο ένας στον άλλο:
— κατά την ηλεκτρολυτική διάσταση ομοιοπολικών ενώσεων στο νερό, ο ομοιοπολικός πολικός δεσμός μετατρέπεται σε ιοντικό δεσμό.
- όταν τα μέταλλα εξατμίζονται, ο μεταλλικός δεσμός μετατρέπεται σε μη πολικό ομοιοπολικό δεσμό κ.λπ.
Ο λόγος για την ενότητα όλων των τύπων και τύπων χημικών δεσμών είναι η πανομοιότυπη χημική φύση τους - η αλληλεπίδραση ηλεκτρονίου-πυρηνικής. Ο σχηματισμός ενός χημικού δεσμού σε κάθε περίπτωση είναι το αποτέλεσμα της αλληλεπίδρασης ηλεκτρονίων-πυρηνικών ατόμων, που συνοδεύεται από την απελευθέρωση ενέργειας.
Μέθοδοι σχηματισμού ομοιοπολικών δεσμών. Χαρακτηριστικά ενός ομοιοπολικού δεσμού: μήκος και ενέργεια δεσμού
Ο ομοιοπολικός χημικός δεσμός είναι ένας δεσμός που σχηματίζεται μεταξύ ατόμων μέσω του σχηματισμού κοινών ζευγών ηλεκτρονίων.
Ο μηχανισμός σχηματισμού ενός τέτοιου δεσμού μπορεί να είναι ανταλλαγή ή δότης-δέκτης.
ΕΓΩ. Μηχανισμός ανταλλαγήςλειτουργεί όταν τα άτομα σχηματίζουν κοινά ζεύγη ηλεκτρονίων συνδυάζοντας ασύζευκτα ηλεκτρόνια.
1) $H_2$ - υδρογόνο:
Ο δεσμός προκύπτει λόγω του σχηματισμού ενός κοινού ζεύγους ηλεκτρονίων από $s$-ηλεκτρόνια ατόμων υδρογόνου (επικαλυπτόμενα $s$-τροχιακά):

2) $HCl$ - υδροχλώριο:
Ο δεσμός προκύπτει λόγω του σχηματισμού ενός κοινού ζεύγους ηλεκτρονίων από ηλεκτρονίων $s-$ και $p-$ (επικαλυπτόμενα $s-p-$τροχιακά):
3) $Cl_2$: σε ένα μόριο χλωρίου, σχηματίζεται ένας ομοιοπολικός δεσμός λόγω μη ζευγαρωμένων ηλεκτρονίων $p-$ (επικαλυπτόμενα $p-p-$τροχιακά):

4) $N_2$: σε ένα μόριο αζώτου σχηματίζονται τρία κοινά ζεύγη ηλεκτρονίων μεταξύ των ατόμων:
II. Μηχανισμός δότη-δέκτηΑς εξετάσουμε το σχηματισμό ενός ομοιοπολικού δεσμού χρησιμοποιώντας το παράδειγμα του ιόντος αμμωνίου $NH_4^+$.

Ο δότης έχει ένα ζεύγος ηλεκτρονίων, ο δέκτης έχει ένα κενό τροχιακό που μπορεί να καταλάβει αυτό το ζεύγος. Στο ιόν αμμωνίου, και οι τέσσερις δεσμοί με άτομα υδρογόνου είναι ομοιοπολικοί: τρεις σχηματίστηκαν λόγω της δημιουργίας κοινών ζευγών ηλεκτρονίων από το άτομο αζώτου και τα άτομα υδρογόνου σύμφωνα με τον μηχανισμό ανταλλαγής, ένας - μέσω του μηχανισμού δότη-δέκτη.
Οι ομοιοπολικοί δεσμοί μπορούν να ταξινομηθούν από τον τρόπο επικάλυψης των τροχιακών ηλεκτρονίων, καθώς και από τη μετατόπισή τους προς ένα από τα συνδεδεμένα άτομα.
Οι χημικοί δεσμοί που σχηματίζονται ως αποτέλεσμα επικαλυπτόμενων τροχιακών ηλεκτρονίων κατά μήκος μιας γραμμής δεσμού ονομάζονται $σ$ -ομόλογα (ομόλογα sigma). Ο δεσμός σίγμα είναι πολύ ισχυρός.

Τα τροχιακά $p-$ μπορούν να επικαλύπτονται σε δύο περιοχές, σχηματίζοντας έναν ομοιοπολικό δεσμό λόγω πλευρικής επικάλυψης:

Χημικοί δεσμοί που σχηματίζονται ως αποτέλεσμα «πλευρικής» επικάλυψης τροχιακών ηλεκτρονίων έξω από τη γραμμή επικοινωνίας, δηλ. σε δύο περιοχές ονομάζονται $π$ -ομόλογα (pi-bonds).
Με βαθμό μετατόπισηςμοιράζονται ζεύγη ηλεκτρονίων σε ένα από τα άτομα που δεσμεύουν, μπορεί να είναι ένας ομοιοπολικός δεσμός πολικόςΚαι μη πολικό.
Ο ομοιοπολικός χημικός δεσμός που σχηματίζεται μεταξύ ατόμων με την ίδια ηλεκτραρνητικότητα ονομάζεται μη πολικό.Τα ζεύγη ηλεκτρονίων δεν μετατοπίζονται σε κανένα από τα άτομα, γιατί Τα άτομα έχουν το ίδιο EO - την ιδιότητα να προσελκύουν ηλεκτρόνια σθένους από άλλα άτομα. Για παράδειγμα:
εκείνοι. μόρια απλών μη μεταλλικών ουσιών σχηματίζονται μέσω ομοιοπολικών μη πολικών δεσμών. Ονομάζεται ομοιοπολικός χημικός δεσμός μεταξύ ατόμων στοιχείων των οποίων η ηλεκτραρνητικότητα διαφέρει πολικός.
Μήκος και ενέργεια ομοιοπολικών δεσμών.
Χαρακτηριστικό γνώρισμα ιδιότητες του ομοιοπολικού δεσμού- το μήκος και την ενέργειά του. Μήκος συνδέσμουείναι η απόσταση μεταξύ των πυρήνων των ατόμων. Όσο μικρότερο είναι το μήκος ενός χημικού δεσμού, τόσο ισχυρότερος είναι. Ωστόσο, ένα μέτρο της δύναμης της σύνδεσης είναι δεσμευτική ενέργεια, το οποίο καθορίζεται από την ποσότητα ενέργειας που απαιτείται για να σπάσει ένας δεσμός. Συνήθως μετριέται σε kJ/mol. Έτσι, σύμφωνα με πειραματικά δεδομένα, τα μήκη δεσμών των μορίων $H_2, Cl_2$ και $N_2$ είναι αντίστοιχα $0,074, 0,198$ και $0,109$ nm, και οι ενέργειες των δεσμών είναι αντίστοιχα $436, 242$ και $946$ kJ/mol.
Ιόντα. Ιοντικός δεσμός
Ας φανταστούμε ότι δύο άτομα «συναντιούνται»: ένα άτομο ενός μετάλλου της ομάδας Ι και ένα άτομο μη μετάλλου της ομάδας VII. Ένα άτομο μετάλλου έχει ένα μόνο ηλεκτρόνιο στο εξωτερικό ενεργειακό του επίπεδο, ενώ ένα μη μεταλλικό άτομο δεν έχει απλώς ένα ηλεκτρόνιο για να είναι πλήρες το εξωτερικό του επίπεδο.
Το πρώτο άτομο θα δώσει εύκολα στο δεύτερο το ηλεκτρόνιό του, το οποίο βρίσκεται μακριά από τον πυρήνα και είναι ασθενώς συνδεδεμένο με αυτόν, και το δεύτερο θα του παρέχει μια ελεύθερη θέση στο εξωτερικό του ηλεκτρονικό επίπεδο.
Τότε το άτομο, που στερείται ένα από τα αρνητικά του φορτία, θα γίνει θετικά φορτισμένο σωματίδιο και το δεύτερο θα μετατραπεί σε αρνητικά φορτισμένο σωματίδιο λόγω του ηλεκτρονίου που προκύπτει. Τέτοια σωματίδια ονομάζονται ιόντων.
Ο χημικός δεσμός που εμφανίζεται μεταξύ των ιόντων ονομάζεται ιονικός.
Ας εξετάσουμε τον σχηματισμό αυτού του δεσμού χρησιμοποιώντας το παράδειγμα της γνωστής ένωσης χλωριούχο νάτριο (επιτραπέζιο αλάτι):
Η διαδικασία μετατροπής των ατόμων σε ιόντα απεικονίζεται στο διάγραμμα:

Αυτός ο μετασχηματισμός των ατόμων σε ιόντα συμβαίνει πάντα κατά την αλληλεπίδραση ατόμων τυπικών μετάλλων και τυπικών αμετάλλων.
Ας εξετάσουμε τον αλγόριθμο (ακολουθία) συλλογισμού κατά την καταγραφή του σχηματισμού ενός ιοντικού δεσμού, για παράδειγμα, μεταξύ ατόμων ασβεστίου και χλωρίου:

Οι αριθμοί που δείχνουν τον αριθμό των ατόμων ή των μορίων ονομάζονται συντελεστές, και οι αριθμοί που δείχνουν τον αριθμό των ατόμων ή ιόντων σε ένα μόριο ονομάζονται ευρετήρια.
Μεταλλική σύνδεση
Ας εξοικειωθούμε με το πώς αλληλεπιδρούν άτομα μεταλλικών στοιχείων μεταξύ τους. Τα μέταλλα συνήθως δεν υπάρχουν ως μεμονωμένα άτομα, αλλά με τη μορφή τεμαχίου, πλινθώματος ή μεταλλικού προϊόντος. Τι συγκρατεί τα άτομα μετάλλου σε έναν μόνο όγκο;
Τα άτομα των περισσότερων μετάλλων περιέχουν μικρό αριθμό ηλεκτρονίων στο εξωτερικό επίπεδο - $1, 2, 3$. Αυτά τα ηλεκτρόνια αφαιρούνται εύκολα και τα άτομα γίνονται θετικά ιόντα. Τα αποσπασμένα ηλεκτρόνια μετακινούνται από το ένα ιόν στο άλλο, δεσμεύοντάς τα σε ένα ενιαίο σύνολο. Συνδέοντας με ιόντα, αυτά τα ηλεκτρόνια σχηματίζουν προσωρινά άτομα, μετά αποσπώνται ξανά και συνδυάζονται με ένα άλλο ιόν κ.λπ. Κατά συνέπεια, στον όγκο του μετάλλου, τα άτομα μετατρέπονται συνεχώς σε ιόντα και αντίστροφα.
Ο δεσμός σε μέταλλα μεταξύ ιόντων μέσω κοινών ηλεκτρονίων ονομάζεται μεταλλικός.
Το σχήμα δείχνει σχηματικά τη δομή ενός μεταλλικού θραύσματος νατρίου.

Σε αυτή την περίπτωση, ένας μικρός αριθμός κοινών ηλεκτρονίων δεσμεύει μεγάλο αριθμό ιόντων και ατόμων.

Ο μεταλλικός δεσμός έχει κάποιες ομοιότητες με τον ομοιοπολικό δεσμό, αφού βασίζεται στην κοινή χρήση εξωτερικών ηλεκτρονίων. Ωστόσο, με έναν ομοιοπολικό δεσμό, τα εξωτερικά ασύζευκτα ηλεκτρόνια μόνο δύο γειτονικών ατόμων μοιράζονται, ενώ με έναν μεταλλικό δεσμό, όλα τα άτομα συμμετέχουν στην κοινή χρήση αυτών των ηλεκτρονίων. Γι' αυτό οι κρύσταλλοι με ομοιοπολικό δεσμό είναι εύθραυστοι, αλλά με μεταλλικό δεσμό, κατά κανόνα, είναι όλκιμοι, ηλεκτρικά αγώγιμοι και έχουν μεταλλική λάμψη.
Η μεταλλική συγκόλληση είναι χαρακτηριστική τόσο για τα καθαρά μέταλλα όσο και για τα μείγματα διαφόρων μετάλλων—κράματα σε στερεά και υγρή κατάσταση.
Δεσμός υδρογόνου
Ένας χημικός δεσμός μεταξύ θετικά πολωμένων ατόμων υδρογόνου ενός μορίου (ή μέρους αυτού) και αρνητικά πολωμένων ατόμων ισχυρά ηλεκτραρνητικών στοιχείων που έχουν μόνα ζεύγη ηλεκτρονίων ($F, O, N$ και σπανιότερα $S$ και $Cl$) ενός άλλου μορίου (ή το μέρος του) ονομάζεται υδρογόνο.
Ο μηχανισμός σχηματισμού δεσμού υδρογόνου είναι εν μέρει ηλεκτροστατικός, εν μέρει δότης-δέκτης.
Παραδείγματα διαμοριακών δεσμών υδρογόνου:
Με την παρουσία μιας τέτοιας σύνδεσης, ακόμη και ουσίες χαμηλού μοριακού βάρους μπορεί, υπό κανονικές συνθήκες, να είναι υγρά (οινόπνευμα, νερό) ή αέρια που υγροποιούνται εύκολα (αμμωνία, υδροφθόριο).
Οι ουσίες με δεσμούς υδρογόνου έχουν μοριακά κρυσταλλικά πλέγματα.
Ουσίες μοριακής και μη μοριακής δομής. Τύπος κρυσταλλικού πλέγματος. Εξάρτηση των ιδιοτήτων των ουσιών από τη σύσταση και τη δομή τους
Μοριακή και μη μοριακή δομή ουσιών
Δεν είναι μεμονωμένα άτομα ή μόρια που εισέρχονται σε χημικές αλληλεπιδράσεις, αλλά ουσίες. Υπό δεδομένες συνθήκες, μια ουσία μπορεί να βρίσκεται σε μία από τις τρεις καταστάσεις συσσωμάτωσης: στερεή, υγρή ή αέρια. Οι ιδιότητες μιας ουσίας εξαρτώνται επίσης από τη φύση του χημικού δεσμού μεταξύ των σωματιδίων που τη σχηματίζουν - μόρια, άτομα ή ιόντα. Ανάλογα με τον τύπο του δεσμού διακρίνονται ουσίες μοριακής και μη μοριακής δομής.
Οι ουσίες που αποτελούνται από μόρια ονομάζονται μοριακές ουσίες. Οι δεσμοί μεταξύ των μορίων σε τέτοιες ουσίες είναι πολύ αδύναμοι, πολύ πιο αδύναμοι από ό,τι μεταξύ των ατόμων μέσα στο μόριο, και ακόμη και σε σχετικά χαμηλές θερμοκρασίες σπάνε - η ουσία μετατρέπεται σε υγρό και στη συνέχεια σε αέριο (εξάχνωση ιωδίου). Τα σημεία τήξης και βρασμού των ουσιών που αποτελούνται από μόρια αυξάνονται με την αύξηση του μοριακού βάρους.
Οι μοριακές ουσίες περιλαμβάνουν ουσίες με ατομική δομή ($C, Si, Li, Na, K, Cu, Fe, W$), μεταξύ αυτών υπάρχουν μέταλλα και αμέταλλα.
Ας εξετάσουμε τις φυσικές ιδιότητες των αλκαλικών μετάλλων. Η σχετικά χαμηλή αντοχή δεσμού μεταξύ των ατόμων προκαλεί χαμηλή μηχανική αντοχή: τα αλκαλικά μέταλλα είναι μαλακά και μπορούν εύκολα να κοπούν με ένα μαχαίρι.
Τα μεγάλα ατομικά μεγέθη οδηγούν σε χαμηλές πυκνότητες αλκαλιμετάλλων: το λίθιο, το νάτριο και το κάλιο είναι ακόμη πιο ελαφριά από το νερό. Στην ομάδα των αλκαλικών μετάλλων, τα σημεία βρασμού και τήξης μειώνονται με την αύξηση του ατομικού αριθμού του στοιχείου, επειδή Τα μεγέθη των ατόμων αυξάνονται και οι δεσμοί εξασθενούν.
Σε ουσίες μη μοριακόΟι δομές περιλαμβάνουν ιοντικές ενώσεις. Οι περισσότερες ενώσεις μετάλλων με αμέταλλα έχουν αυτή τη δομή: όλα τα άλατα ($NaCl, K_2SO_4$), μερικά υδρίδια ($LiH$) και οξείδια ($CaO, MgO, FeO$), βάσεις ($NaOH, KOH$). Οι ιοντικές (μη μοριακές) ουσίες έχουν υψηλά σημεία τήξης και βρασμού.
Κρυσταλλικά πλέγματα
Η ύλη, όπως είναι γνωστό, μπορεί να υπάρχει σε τρεις καταστάσεις συσσωμάτωσης: αέρια, υγρή και στερεή.
Στερεά: άμορφα και κρυσταλλικά.
Ας εξετάσουμε πώς τα χαρακτηριστικά των χημικών δεσμών επηρεάζουν τις ιδιότητες των στερεών. Τα στερεά χωρίζονται σε κρυστάλλινοςΚαι άμορφος.
Οι άμορφες ουσίες δεν έχουν διαυγές σημείο τήξης όταν θερμαίνονται, μαλακώνουν σταδιακά και μετατρέπονται σε ρευστή κατάσταση. Για παράδειγμα, η πλαστελίνη και οι διάφορες ρητίνες είναι σε άμορφη κατάσταση.
Οι κρυσταλλικές ουσίες χαρακτηρίζονται από τη σωστή διάταξη των σωματιδίων από τα οποία αποτελούνται: άτομα, μόρια και ιόντα - σε αυστηρά καθορισμένα σημεία του χώρου. Όταν αυτά τα σημεία συνδέονται με ευθείες γραμμές, σχηματίζεται ένα χωρικό πλαίσιο, που ονομάζεται κρυσταλλικό πλέγμα. Τα σημεία στα οποία βρίσκονται τα κρυσταλλικά σωματίδια ονομάζονται κόμβοι πλέγματος.
Ανάλογα με τον τύπο των σωματιδίων που βρίσκονται στους κόμβους του κρυσταλλικού πλέγματος και τη φύση της μεταξύ τους σύνδεσης, διακρίνονται τέσσερις τύποι κρυσταλλικών δικτυωμάτων: ιονική, ατομική, μοριακήΚαι μέταλλο.
Ιωνικά κρυσταλλικά πλέγματα.
ιωνικόςονομάζονται κρυσταλλικά πλέγματα, στους κόμβους των οποίων υπάρχουν ιόντα. Σχηματίζονται από ουσίες με ιοντικούς δεσμούς, οι οποίοι μπορούν να δεσμεύουν τόσο απλά ιόντα $Na^(+), Cl^(-)$ και σύνθετα $SO_4^(2−), OH^-$. Κατά συνέπεια, τα άλατα και ορισμένα οξείδια και υδροξείδια μετάλλων έχουν ιοντικά κρυσταλλικά πλέγματα. Για παράδειγμα, ένας κρύσταλλος χλωριούχου νατρίου αποτελείται από εναλλασσόμενα θετικά ιόντα $Na^+$ και αρνητικά $Cl^-$, σχηματίζοντας ένα πλέγμα σε σχήμα κύβου. Οι δεσμοί μεταξύ ιόντων σε έναν τέτοιο κρύσταλλο είναι πολύ σταθεροί. Επομένως, ουσίες με ιοντικό πλέγμα χαρακτηρίζονται από σχετικά υψηλή σκληρότητα και αντοχή, είναι πυρίμαχες και μη πτητικές.

Ατομικά κρυσταλλικά πλέγματα.
Ατομικόςονομάζονται κρυσταλλικά πλέγματα, στους κόμβους των οποίων υπάρχουν μεμονωμένα άτομα. Σε τέτοια πλέγματα, τα άτομα συνδέονται μεταξύ τους με πολύ ισχυρούς ομοιοπολικούς δεσμούς. Ένα παράδειγμα ουσιών με αυτού του τύπου κρυσταλλικά πλέγματα είναι το διαμάντι, μια από τις αλλοτροπικές τροποποιήσεις του άνθρακα.
Οι περισσότερες ουσίες με ατομικό κρυσταλλικό πλέγμα έχουν πολύ υψηλά σημεία τήξης (για παράδειγμα, για το διαμάντι είναι πάνω από $3500°C), είναι ισχυρές και σκληρές και πρακτικά αδιάλυτες.

Μοριακά κρυσταλλικά πλέγματα.
Μοριακόςπου ονομάζονται κρυσταλλικά πλέγματα, στους κόμβους των οποίων βρίσκονται τα μόρια. Οι χημικοί δεσμοί σε αυτά τα μόρια μπορεί να είναι και πολικοί ($HCl, H_2O$) και μη πολικοί ($N_2, O_2$). Παρά το γεγονός ότι τα άτομα μέσα στα μόρια συνδέονται με πολύ ισχυρούς ομοιοπολικούς δεσμούς, ασθενείς διαμοριακές δυνάμεις έλξης δρουν μεταξύ των ίδιων των μορίων. Επομένως, ουσίες με μοριακά κρυσταλλικά πλέγματα έχουν χαμηλή σκληρότητα, χαμηλά σημεία τήξης και είναι πτητικές. Οι περισσότερες στερεές οργανικές ενώσεις έχουν μοριακά κρυσταλλικά πλέγματα (ναφθαλίνη, γλυκόζη, ζάχαρη).

Μεταλλικά κρυσταλλικά πλέγματα.
Οι ουσίες με μεταλλικούς δεσμούς έχουν μεταλλικά κρυσταλλικά πλέγματα. Στις θέσεις τέτοιων δικτυωμάτων υπάρχουν άτομα και ιόντα (είτε άτομα είτε ιόντα, στα οποία μετατρέπονται εύκολα τα μεταλλικά άτομα, δίνοντας τα εξωτερικά τους ηλεκτρόνια «για κοινή χρήση»). Αυτή η εσωτερική δομή των μετάλλων καθορίζει τις χαρακτηριστικές φυσικές τους ιδιότητες: ελατότητα, ολκιμότητα, ηλεκτρική και θερμική αγωγιμότητα, χαρακτηριστική μεταλλική λάμψη.
Η ηλεκτροαρνητικότητα είναι η ιδιότητα ενός χημικού στοιχείου να έλκει ηλεκτρόνια στο άτομό του από άτομα άλλων στοιχείων με τα οποία αυτό το στοιχείο σχηματίζει χημικό δεσμό σε ενώσεις.
Όταν σχηματίζεται ένας χημικός δεσμός μεταξύ ατόμων διαφορετικών στοιχείων, το κοινό νέφος ηλεκτρονίων μετατοπίζεται σε ένα πιο ηλεκτραρνητικό άτομο, γι' αυτό ο δεσμός γίνεται ομοιοπολικά πολικός και αν η διαφορά στην ηλεκτραρνητικότητα είναι μεγάλη, γίνεται ιοντικός.
Η ηλεκτροαρνητικότητα λαμβάνεται υπόψη κατά τη σύνταξη χημικών τύπων: στις δυαδικές ενώσεις, το σύμβολο του πιο ηλεκτραρνητικού στοιχείου αναγράφεται στο πίσω μέρος.
Η ηλεκτροαρνητικότητα αυξάνεται από αριστερά προς τα δεξιά για στοιχεία κάθε περιόδου και μειώνεται από πάνω προς τα κάτω για στοιχεία της ίδιας ομάδας PS.
ΣθένοςΈνα στοιχείο είναι η ιδιότητα των ατόμων του να συνδυάζονται με έναν ορισμένο αριθμό άλλων ατόμων.
Υπάρχουν στοιχειομετρικός, ηλεκτρονικός σθένος και αριθμός συντονισμού. Θα εξετάσουμε μόνο το στοιχειομετρικό σθένος.
ΣτοιχειομετρικήΤο σθένος δείχνει πόσα άτομα ενός άλλου στοιχείου είναι συνδεδεμένα σε ένα άτομο ενός δεδομένου στοιχείου. Το σθένος του υδρογόνου λαμβάνεται ως μονάδα σθένους, επειδή Το υδρογόνο είναι πάντα μονοσθενές. Για παράδειγμα, στις ενώσεις HCl, H 2 O, NH 3 (η σωστή γραφή της αμμωνίας H 3 N χρησιμοποιείται ήδη στα σύγχρονα σχολικά βιβλία), το CH 4 χλώριο είναι μονοσθενές, το οξυγόνο είναι δισθενές, το άζωτο είναι τρισθενές και ο άνθρακας είναι τετρασθενής.
Το στοιχειομετρικό σθένος του οξυγόνου είναι συνήθως 2. Δεδομένου ότι σχεδόν όλα τα στοιχεία σχηματίζουν ενώσεις με το οξυγόνο, είναι βολικό να χρησιμοποιείται ως πρότυπο για τον προσδιορισμό του σθένους ενός άλλου στοιχείου. Για παράδειγμα, στις ενώσεις Na 2 O, CoO, Fe 2 O 3, SO 3, το νάτριο είναι μονοσθενές, το κοβάλτιο είναι δισθενές, ο σίδηρος είναι τρισθενής, το θείο είναι εξασθενές.
Στις αντιδράσεις οξειδοαναγωγής, θα είναι σημαντικό για εμάς να προσδιορίσουμε τις καταστάσεις οξείδωσης των στοιχείων.
Κατάσταση οξείδωσηςενός στοιχείου σε μια ουσία ονομάζεται στοιχειομετρικό σθένος, λαμβανόμενο με πρόσημο συν ή πλην.
Τα χημικά στοιχεία χωρίζονται σε στοιχεία σταθερού σθένους και σε στοιχεία μεταβλητού σθένους.
1.3.3. Ουσίες μοριακής και μη μοριακής δομής. Τύπος κρυσταλλικού πλέγματος. Εξάρτηση των ιδιοτήτων των ουσιών από τη σύνθεση και τη δομή τους.
Ανάλογα με την κατάσταση στην οποία βρίσκονται οι ενώσεις στη φύση, χωρίζονται σε μοριακές και μη μοριακές. Στις μοριακές ουσίες, τα μικρότερα δομικά σωματίδια είναι μόρια. Αυτές οι ουσίες έχουν ένα μοριακό κρυσταλλικό πλέγμα. Στις μη μοριακές ουσίες, τα μικρότερα δομικά σωματίδια είναι άτομα ή ιόντα. Το κρυσταλλικό τους πλέγμα είναι ατομικό, ιοντικό ή μεταλλικό.
Ο τύπος του κρυσταλλικού πλέγματος καθορίζει σε μεγάλο βαθμό τις ιδιότητες των ουσιών. Για παράδειγμα, μέταλλα που έχουν τύπου μεταλλικό πλέγμα, διαφορετικό από όλα τα άλλα στοιχεία υψηλή πλαστικότητα, ηλεκτρική και θερμική αγωγιμότητα. Αυτές οι ιδιότητες, καθώς και πολλές άλλες - ελατότητα, μεταλλική λάμψη κ.λπ. προκαλούνται από έναν ειδικό τύπο δεσμού μεταξύ ατόμων μετάλλου - μεταλλική σύνδεση.Πρέπει να σημειωθεί ότι οι ιδιότητες που είναι εγγενείς στα μέταλλα εμφανίζονται μόνο στη συμπυκνωμένη κατάσταση. Για παράδειγμα, ο άργυρος σε αέρια κατάσταση δεν έχει τις φυσικές ιδιότητες των μετάλλων.
Ένας ειδικός τύπος δεσμού στα μέταλλα – μεταλλικός – προκαλείται από ανεπάρκεια ηλεκτρονίων σθένους, επομένως είναι κοινά σε ολόκληρη τη δομή του μετάλλου. Το απλούστερο μοντέλο της δομής των μετάλλων υπέθεσε ότι το κρυσταλλικό πλέγμα των μετάλλων αποτελείται από θετικά ιόντα που περιβάλλονται από ελεύθερα ηλεκτρόνια η κίνηση των ηλεκτρονίων συμβαίνει χαοτικά, όπως τα μόρια αερίου. Ωστόσο, ένα τέτοιο μοντέλο, ενώ εξηγεί ποιοτικά πολλές ιδιότητες των μετάλλων, αποδεικνύεται ανεπαρκές όταν ελέγχεται ποσοτικά. Η περαιτέρω ανάπτυξη της θεωρίας της μεταλλικής κατάστασης οδήγησε στη δημιουργία θεωρία ζώνης μετάλλων, το οποίο βασίζεται στις έννοιες της κβαντικής μηχανικής.
Οι θέσεις του κρυσταλλικού πλέγματος περιέχουν κατιόντα και άτομα μετάλλου και τα ηλεκτρόνια κινούνται ελεύθερα σε όλο το κρυσταλλικό πλέγμα.
Μια χαρακτηριστική μηχανική ιδιότητα των μετάλλων είναι πλαστική ύλη, λόγω των ιδιαιτεροτήτων της εσωτερικής δομής των κρυστάλλων τους. Ως πλαστικότητα νοείται η ικανότητα των σωμάτων υπό την επίδραση εξωτερικών δυνάμεων να υφίστανται παραμόρφωση, η οποία παραμένει ακόμη και μετά την παύση της εξωτερικής επιρροής. Αυτή η ιδιότητα των μετάλλων τους επιτρέπει να διαμορφώνονται σε διαφορετικά σχήματα κατά τη σφυρηλάτηση, το μέταλλο μπορεί να τυλιχτεί σε φύλλα ή να τραβήξει σε σύρμα.
Η πλαστικότητα των μετάλλων οφείλεται στο γεγονός ότι, υπό εξωτερική επίδραση, τα στρώματα ιόντων που σχηματίζουν το κρυσταλλικό πλέγμα μετατοπίζονται μεταξύ τους χωρίς να σπάνε. Αυτό συμβαίνει ως αποτέλεσμα του γεγονότος ότι τα κινούμενα ηλεκτρόνια, λόγω της ελεύθερης ανακατανομής, συνεχίζουν να επικοινωνούν μεταξύ των ιοντικών στοιβάδων. Όταν μια στερεή ουσία με ατομικό πλέγμα υποβάλλεται σε μηχανική δράση, τα μεμονωμένα στρώματά της μετατοπίζονται και η πρόσφυση μεταξύ τους διαταράσσεται λόγω της θραύσης των ομοιοπολικών δεσμών.
ιόντων, τότε σχηματίζονται αυτές οι ουσίες ιοντικός τύπος κρυσταλλικού πλέγματος.


Αυτά είναι άλατα, καθώς και οξείδια και υδροξείδια τυπικών μετάλλων. Αυτές είναι σκληρές, εύθραυστες ουσίες, αλλά η κύρια ποιότητά τους είναι : διαλύματα και τήγματα αυτών των ενώσεων φέρουν ηλεκτρικό ρεύμα.
Αν οι κόμβοι του κρυσταλλικού πλέγματος περιέχουν άτομα, τότε σχηματίζονται αυτές οι ουσίες ατομικός τύπος κρυσταλλικού πλέγματος(οξείδια διαμαντιού, βορίου, πυριτίου, αλουμινίου και πυριτίου). Οι ιδιότητες είναι πολύ σκληρές και πυρίμαχες, αδιάλυτες στο νερό.
Αν οι κόμβοι του κρυσταλλικού πλέγματος περιέχουν μόρια, τότε σχηματίζονται αυτές οι ουσίες (υπό κανονικές συνθήκες, αέρια και υγρά: O 2, HCl, I 2 οργανικές ουσίες).
Είναι ενδιαφέρον να σημειωθεί το μεταλλικό γάλλιο, το οποίο λιώνει σε θερμοκρασία 30 o C. Αυτή η ανωμαλία εξηγείται από το γεγονός ότι τα μόρια Ga 2 βρίσκονται στους κόμβους του κρυσταλλικού πλέγματος και οι ιδιότητές του γίνονται παρόμοιες με ουσίες που έχουν μοριακό κρυσταλλικού πλέγματος.

Παράδειγμα.Όλα τα αμέταλλα της ομάδας έχουν μη μοριακή δομή:
1) άνθρακας, βόριο, πυρίτιο; 2) φθόριο, βρώμιο, ιώδιο.
3) οξυγόνο, θείο, άζωτο; 4) χλώριο, φώσφορο, σελήνιο.
Στις μη μοριακές ουσίες, τα μικρότερα δομικά σωματίδια είναι άτομα ή ιόντα. Το κρυσταλλικό τους πλέγμα είναι ατομικό, ιοντικό ή μεταλλικό
Στο απόφασηΕίναι πιο εύκολο να προσεγγίσετε αυτήν την ερώτηση από την αντίθετη κατεύθυνση. Αν οι κόμβοι του κρυσταλλικού πλέγματος περιέχουν μόρια, τότε σχηματίζονται αυτές οι ουσίες μοριακός τύπος κρυσταλλικού πλέγματος(υπό κανονικές συνθήκες, αέρια και υγρά: O 2, HCl· επίσης I 2, ορθορομβικό θείο S 8, λευκός φώσφορος P 4, οργανικές ουσίες). Όσον αφορά τις ιδιότητες, αυτές είναι εύθραυστες, εύτηκτες ενώσεις.
Η δεύτερη απάντηση περιέχει αέριο φθόριο, η τρίτη περιέχει αέρια οξυγόνου και αζώτου και η τέταρτη περιέχει αέριο χλώριο. Αυτό σημαίνει ότι αυτές οι ουσίες έχουν ένα μοριακό κρυσταλλικό πλέγμα και μια μοριακή δομή.
ΣΕ πρώταΗ απάντηση είναι ότι όλες οι ουσίες είναι στερεές ενώσεις υπό κανονικές συνθήκες και σχηματίζουν ένα ατομικό πλέγμα, που σημαίνει ότι έχουν μη μοριακή δομή.
Σωστή απάντηση:1) άνθρακα, βόριο, πυρίτιο
Διάλεξη: Ουσίες μοριακής και μη μοριακής δομής. Τύπος κρυσταλλικού πλέγματος. Εξάρτηση των ιδιοτήτων των ουσιών από τη σύσταση και τη δομή τους
Μοριακές και μη μοριακές ουσίες
Σύμφωνα με τη δομή τους, οι χημικές ουσίες χωρίζονται σε δύο ομάδες: ονομάζονται αυτές που αποτελούνται από μόρια μοριακόςκαι περιέχει άτομα και ιόντα – μη μοριακό.
Οι μοριακές ουσίες έχουν χαμηλά σημεία τήξης/βρασμού. Μπορούν να βρίσκονται σε τρεις καταστάσεις συσσωμάτωσης: υγρό, στερεό, αέριο. Αυτή η ομάδα περιλαμβάνει τις περισσότερες από τις απλές ουσίες των μη μετάλλων, καθώς και τις ενώσεις τους μεταξύ τους. Οι δεσμοί μεταξύ των ατόμων των μοριακών ουσιών είναι ομοιοπολικοί.
Οι μη μοριακές ουσίες έχουν υψηλά σημεία τήξης/βρασμού. Βρίσκονται σε σταθερή κατάσταση. Αυτές, όπως μαντέψατε, είναι απλές μεταλλικές ουσίες, οι ενώσεις τους με αμέταλλα, αμέταλλα περιλαμβάνουν βόριο, άνθρακα - διαμάντι, φώσφορο (μαύρο και κόκκινο), πυρίτιο. Οι μη μοριακές ουσίες σχηματίζουν ιοντικούς, ατομικούς και μοριακούς κρυστάλλους, η διάταξη των σωματιδίων των οποίων έχει μια σαφή ακολουθία και σχηματίζει ένα πλέγμα.
Τύποι κρυσταλλικών δικτυωμάτων
Υπάρχουν τέσσερις τύποι κρυσταλλικών δικτυωμάτων, ανάλογα με τους τύπους σωματιδίων που βρίσκονται στους κόμβους του πλέγματος:

1) Ιωνικότο κρυσταλλικό πλέγμα είναι χαρακτηριστικό ενώσεων με ιοντικό τύπο χημικού δεσμού. Τα κατιόντα και τα ανιόντα βρίσκονται σε δικτυακές θέσεις. Παραδείγματα ουσιών με αυτόν τον τύπο κρυσταλλικού πλέγματος είναι άλατα, οξείδια και υδροξείδια τυπικών μετάλλων. Αυτές είναι σκληρές αλλά εύθραυστες ουσίες. Χαρακτηρίζονται από ανθεκτικότητα. Διαλύονται στο νερό και είναι ηλεκτρικά αγώγιμα.

2) Πυρηνικάτο πλέγμα έχει άτομα στους κόμβους του. Τα σωματίδια σχηματίζουν ομοιοπολικούς μη πολικούς και πολικούς δεσμούς. Από τις απλές ουσίες, αυτός ο τύπος κρυσταλλικού πλέγματος ανήκει στον άνθρακα στην κατάσταση του γραφίτη και του διαμαντιού, του βορίου, του πυριτίου και του γερμανίου. Από τις σύνθετες ουσίες, για παράδειγμα, το οξείδιο του πυριτίου (χαλαζίας, πέτρινος κρύσταλλος) έχει ατομικό πλέγμα. Αυτές είναι πολύ σκληρές, πυρίμαχες ουσίες, όχι πολύ συνηθισμένες στη φύση. Δεν διαλύονται στο νερό.

3) ΜοριακήΤο κρυσταλλικό πλέγμα σχηματίζεται από μόρια που συγκρατούνται μεταξύ τους από ασθενείς δυνάμεις διαμοριακής έλξης. Ως εκ τούτου, οι ουσίες αυτού του τύπου πλέγματος χαρακτηρίζονται από χαμηλή σκληρότητα, ευθραυστότητα και χαμηλές θερμοκρασίες τήξης. Για παράδειγμα, αυτό είναι νερό σε παγωμένη κατάσταση. Οι περισσότερες στερεές οργανικές ενώσεις έχουν αυτόν τον τύπο πλέγματος. Ο τύπος του δεσμού στην ένωση είναι ομοιοπολικός.